Stephanie M. Lim1*,
Stephanie M. Lim1*,  Robert Wever2,
Robert Wever2,  Suzan D. Pas3,
Suzan D. Pas3,  Gygliola Bonofacio2,
Gygliola Bonofacio2,  Marion P. G. Koopmans3 y
Marion P. G. Koopmans3 y  Byron E. E. Martina1,3
Byron E. E. Martina1,3- 1Fundación de Investigación Artemis One Health, Delft, Países Bajos
- 2Servicios de Laboratorio Médico, Willemstad, Curazao
- 3Departamento de Virociencia, Centro Colaborador de la OMS para Arbovirus y Fiebres Hemorrágicas, Centro Médico Erasmus, Róterdam, Países Bajos
Antecedentes: El virus del Zika (ZIKV) surgió en mayo de 2015 en Brasil, desde donde se propagó a muchos otros países de América Latina. Eventualmente, también se reportaron casos de infección por ZIKV en Curazao (enero de 2016) y Bonaire (febrero de 2016).
Métodos: En el período comprendido entre el 16 de diciembre de 2015 y el 26 de abril de 2017, se tomaron muestras de suero, plasma-EDTA u orina en los Servicios de Laboratorio Médico (MLS) de pacientes en Curazao y se analizaron mediante qRT-PCR en el Centro Médico Erasmus (EMC) en los Países Bajos. Entre el 17 de octubre de 2016 y el 26 de abril de 2017, todas las muestras de pacientes con sospecha de ZIKV recolectadas en Curazao, así como en Bonaire, se analizaron en MLS. Se analizaron muestras pareadas de orina y/o suero de pacientes para determinar la cinética de eliminación del ZIKV, y se compararon en términos de sensibilidad para la detección del ARN del ZIKV. Además, se utilizaron la edad y el género de los pacientes para determinar las tasas de incidencia del ZIKV, y su ubicación geográfica para determinar la distribución espacial de los casos de ZIKV.
Resultados: En total, 781 pacientes de 2820 individuos analizados resultaron positivos por qRT-PCR para ZIKV en Curazao. Los dos primeros casos de ZIKV se diagnosticaron en diciembre de 2015. Un total de 112 pacientes de 382 individuos analizados resultaron positivos por qRT-PCR para ZIKV en Bonaire. Para ambas islas, el número máximo de casos absolutos ocurrió en noviembre de 2016, con 247 casos confirmados por qRT-PCR en Curazao y 66 casos positivos por qRT-PCR en Bonaire. En general, se diagnosticó una mayor proporción de mujeres que de hombres con ZIKV en ambas islas, así como principalmente individuos en la categoría de edad de 25 a 54 años. Además, los casos de ZIKV se concentraron principalmente en el este de la isla, en Willemstad.
Conclusiones: Los casos de ZIKV confirmados por qRT-PCR indican que el virus estuvo circulando en Curazao entre al menos diciembre de 2015 y marzo de 2017, y en Bonaire entre al menos octubre de 2016 y febrero de 2017, con casos máximos ocurriendo en noviembre de 2016. La falta de preparación de Curazao para el brote de ZIKV se compensó mediante el envío de todas las muestras al EMC para diagnóstico; sin embargo, ambas islas deberán establecer la infraestructura adecuada para permitir una respuesta rápida ante un brote de cualquier nuevo virus emergente en el futuro.
Introducción
El virus del Zika (ZIKV) es un arbovirus que pertenece a la familia Flaviviridae, género Flavivirus, y se transmite a través de la picadura de mosquitos Aedes aegypti infectados, por contacto sexual (1–3), o de madre a feto (4). La infección por ZIKV a menudo es asintomática o de lo contrario se presenta con síntomas leves como fiebre, erupción maculopapular, conjuntivitis, mialgia y cefalea (5). En un pequeño número de casos, la infección por ZIKV puede resultar en complicaciones graves como el síndrome de Guillain-Barré (6–10), maculopatía (11–13), o microcefalia en recién nacidos cuando la madre se infecta con el virus durante el embarazo (14–18).
Históricamente, desde su descubrimiento en Uganda en 1947, el ZIKV se limitaba a África, resultando únicamente en casos esporádicos de enfermedad leve. Sin embargo, en 2007, este patrón cambió cuando el primer brote importante de ZIKV ocurrió en Yap (Estados Federados de Micronesia), donde aproximadamente el 73% de la población fue infectada y la enfermedad sintomática se desarrolló en aproximadamente el 18% de las personas infectadas (19). Desde entonces, el ZIKV se propagó rápidamente a través del Océano Pacífico, causando brotes en la Polinesia Francesa (20), las Islas Cook (20), la Isla de Pascua (21), Nueva Caledonia (22), hasta finalmente emerger en las Américas (23). Aquí se reportó por primera vez en Brasil, en América del Sur continental, en mayo de 2015, después de lo cual el virus se propagó a otros países latinoamericanos, como Colombia (octubre de 2015), Surinam, El Salvador, México, Guatemala, Paraguay, Venezuela (noviembre de 2015), Panamá, Honduras, Guayana Francesa, Martinica, Puerto Rico (diciembre de 2015), Maldivas, Guyana, Ecuador, Barbados, Bolivia, Haití, San Martín, República Dominicana, Nicaragua, Jamaica, Curazao, Costa Rica (enero de 2016), Bonaire y Aruba (febrero de 2016) (24, 25). Solo en Brasil, se ha estimado que entre 440.000 y 1,3 millones de personas fueron infectadas con ZIKV en 2015 (26), y se han reportado alrededor de 2366 casos de microcefalia/malformaciones del SNC asociadas al ZIKV (hasta febrero de 2017, www.statista.com). Desde entonces, la epidemia continuó propagándose, y el número total de personas infectadas y niños con síndrome congénito de ZIKV aún está por determinarse.
Curazao, una nación de casi 150.000 habitantes, es conocida por la circulación de virus transmitidos por A. aegypti, como el virus del dengue (DENV) y el virus chikungunya (CHIKV). El DENV ha sido endémico en Curazao durante décadas y los brotes del virus ocurren aquí cada pocos años. El brote más reciente de dengue ocurrió en 2014, cuando las autoridades sanitarias de Curazao habían reportado 194 casos sospechosos y 20 casos confirmados de dengue a finales de agosto (27). En junio del mismo año, también se reportó el primer caso de CHIKV, que fue el inicio de un importante brote en la isla que duró hasta febrero de 2015. A finales de noviembre de 2014, se habían reportado 1.838 casos sospechosos y 835 casos confirmados de CHIKV (28). El dengue también es endémico en Bonaire, una nación con casi 19.000 habitantes, pero no hay muchos informes disponibles.
Debido al alto grado de reactividad cruzada serológica entre los flavivirus, la confirmación de la infección plantea un desafío. Como se cree que la IgM es más específica que la IgG, la detección de IgM contra el ZIKV mediante ELISA representa una posibilidad; sin embargo, se ha demostrado la reactividad cruzada de IgM del DENV y ZIKV (29). Esto significa que aún se requerirían ensayos de neutralización confirmatorios. Como resultado, la confirmación de infecciones por flavivirus se basa principalmente en la detección de ARN viral en suero mediante el uso de PCR cuantitativa en tiempo real (qRT-PCR). Sin embargo, para varios arbovirus como el DENV o el ZIKV, el nivel de viremia presente en la sangre durante la fase sintomática es a menudo muy bajo, lo que hace problemática la detección. El uso de orina como una matriz alternativa para detectar ARN del ZIKV fue investigado por varios laboratorios y se encontró que era una buena alternativa al suero, plasma-EDTA y saliva, debido a los niveles más altos de ARN encontrados, y el período más largo de tiempo que la orina se encontró positiva después del inicio de los síntomas (>10–20 días) (30, 31). En contraste, otro estudio demostró la detección de ZIKV en sangre completa durante un período de tiempo más largo en comparación con la orina y el suero (32). Basándose en estas observaciones, las recomendaciones provisionales oficiales de la Organización Mundial de la Salud (OMS) incluyeron el uso de sangre completa, suero o orina para las pruebas de ácido nucleico (NAT), y suero para la detección de IgM (33). La confirmación rutinaria de los resultados serológicos mediante ensayos de neutralización de virus no se recomendó por considerarse inviable.
Para definir el alcance del brote de ZIKV en Curazao y Bonaire, determinamos el número de casos confirmados de ZIKV basados en diagnósticos de qRT-PCR, las tasas de incidencia de infección en pacientes en términos de edad y género, así como la distribución geoespacial de los casos de ZIKV en Curazao. Además, se evaluaron muestras de orina pareadas de Curazao para la cinética de excreción del ZIKV, mientras que se compararon muestras pareadas de orina y suero de Bonaire para la sensibilidad de la detección de ARN del ZIKV.
Métodos
En el período comprendido entre el 16 de diciembre de 2015 y el 26 de abril de 2017, se obtuvieron muestras de suero, plasma EDTA u orina en los Servicios de Laboratorio Médico (MLS) de pacientes en Curazao que presentaban síntomas similares a la infección por el virus del Zika (ZIKV), tales como fiebre, erupción cutánea, cefalea o conjuntivitis. Entre el 16 de diciembre de 2015 y el 15 de octubre de 2016, las muestras recolectadas fueron inactivadas y estabilizadas en tampón de lisis MagnaPure (Roche Diagnostics, Almere, Países Bajos) y enviadas al laboratorio de diagnóstico del Centro Médico Erasmus (EMC) en Rotterdam, Países Bajos, donde se analizó el ARN del ZIKV mediante una qRT-PCR semicuantitativa en tiempo real, desarrollada internamente y validada según ISO15189:2012. En resumen, los ácidos nucleicos totales se aislaron utilizando un protocolo de lisis externa en el sistema robótico MagNA Pure LC (Roche Diagnostics) y posteriormente se analizaron en dos qRT-PCRs independientes utilizando TaqMan® 1-Step Fast-Virus Master Mix (Thermo Fisher Scientific, Bleiswijk, Países Bajos) y cebadores dirigidos a la envoltura y al NS2A, en multiplex con un control interno (PDV), en un ciclador LC480-II (Roche Life Science) (Tabla 1). El punto de corte se estableció en valores de <45 CT. A partir del 6 de julio de 2016, solo se utilizó el par de cebadores dirigidos a la envoltura en la qRT-PCR para la confirmación de la infección por ZIKV.
 Tabla 1. Cebadores y sonda de qRT-PCR desarrollados en laboratorio utilizados para el diagnóstico del ZIKV.
Tabla 1. Cebadores y sonda de qRT-PCR desarrollados en laboratorio utilizados para el diagnóstico del ZIKV.
Dado que la etiología de las manifestaciones clínicas de los pacientes aún era incierta durante los primeros 2 meses del brote (diciembre de 2015 y enero de 2016), las muestras de suero recolectadas de los pacientes también se analizaron para detectar ARN del DENV y CHIKV utilizando FTD Dengue/Chik multiplex (Fast Track Diagnostics, Esch-sur-Alzette, Luxemburgo). Entre diciembre de 2015 y octubre de 2016 se enviaron para análisis muestras de orina pareadas (plasma si la orina no estaba disponible) con un intervalo objetivo de aproximadamente 2 semanas. A partir de febrero de 2016, se recolectaron muestras de orina (matriz de elección) o plasma con EDTA (si la orina no estaba disponible) de los pacientes.
En el período comprendido entre el 17 de octubre de 2016 y el 26 de abril de 2017, tras la implementación de ensayos diagnósticos comerciales para ZIKV en MLS, todas las muestras de pacientes con sospecha de ZIKV en Curazao fueron recolectadas y analizadas en MLS. En este período, también se recolectaron muestras de pacientes con sospecha de ZIKV en Bonaire por Fundashon Mariadal y se enviaron a MLS para su análisis. A diferencia de Curazao, aquí se optó por recolectar muestras pareadas de suero y orina el mismo día, de un gran número de pacientes. Las pruebas diagnósticas de ZIKV consistieron en qRT-PCR y/o ELISA IgM/IgG (Euroimmun, Lübeck, Alemania). Para la qRT-PCR, los ácidos nucleicos totales se aislaron utilizando el sistema robótico MagNA Pure (Roche Diagnostics) y se analizaron en una qRT-PCR utilizando FTD Zika virus multiplex (Fast Track Diagnostics). Dependiendo del número de días después del inicio de los síntomas en que el paciente fue sometido a la prueba, se optó por qRT-PCR solo (0-7 días), qRT-PCR y serología (7-14 días), o serología sola (≥14 días). Sin embargo, dado que ni un resultado positivo de IgM o IgG por ELISA para ZIKV en un área endémica de DENV puede considerarse fiable debido a la reactividad cruzada conocida entre los anticuerpos del DENV y del ZIKV (36, 37), solo consideramos los resultados positivos obtenidos en la qRT-PCR para los análisis.
En el período comprendido entre el 17 de octubre de 2016 y el 8 de noviembre de 2016, se analizaron muestras de plasma, pero a partir del 9 de noviembre de 2016, se prefirió el suero sobre el plasma con EDTA debido a su superior practicidad y durabilidad en el laboratorio, y a las recomendaciones realizadas por la Organización Mundial de la Salud (33). La orina ya no era la matriz de elección, ya que el suero podía utilizarse tanto en qRT-PCR como en ELISA.
Curazao puede dividirse en 65 geozonas, que constan de uno o más vecindarios. La geozona de residencia de los pacientes se utilizó como indicador de ubicación y se representó en un mapa de Curazao utilizando www.mapcustomizer.com. Se determinaron las tasas de incidencia del ZIKV para diferentes categorías de edad y el género de los pacientes.
La información como los síntomas de presentación, el día de inicio y el embarazo no fue documentada adecuadamente por los médicos generales ni en Curazao ni en Bonaire, y como resultado, estos datos no pudieron incluirse en los análisis. Cada individuo que proporcionó una muestra de orina, suero o plasma para el análisis otorgó su consentimiento por escrito, y el consentimiento por escrito para los niños menores de 16 años fue proporcionado por sus padres o tutores. Dado que las muestras de los pacientes se recolectaron únicamente con fines diagnósticos, no se requirió autorización ética adicional para este estudio.
Análisis Estadísticos
Las muestras pareadas se analizaron utilizando una prueba t pareada de dos colas y los valores P iguales o inferiores a 0,5 se consideraron estadísticamente significativos.
Resultados
Entre el 16 de diciembre de 2015 y el 26 de abril de 2017, se recolectaron 3.833 muestras de 2.820 individuos por MLS en Curazao. De estas, 2.044 muestras pertenecientes a 1.685 pacientes fueron analizadas mediante qRT-PCR, resultando en 815 muestras positivas por qRT-PCR, correspondientes a 781 pacientes positivos para ZIKV (Tabla 2). Las pruebas de muestras de suero de pacientes con sospecha de ZIKV en Curazao se iniciaron en diciembre de 2015, durante el cual dos pacientes resultaron positivos para ZIKV mediante qRT-PCR. Durante los primeros 2 meses del brote (diciembre de 2015 y enero de 2016), cuando las muestras de suero también se analizaron para DENV y CHIKV mediante qRT-PCR, cuatro de 87 casos sospechosos de ZIKV se confirmaron como positivos para DENV en su lugar (CT 26,6, 14,5, 29,5 y 34,4).
 Tabla 2. Número de muestras recolectadas y analizadas, y el número de pacientes examinados mediante qRT-PCR durante el brote de ZIKV en Curazao y Bonaire.
Tabla 2. Número de muestras recolectadas y analizadas, y el número de pacientes examinados mediante qRT-PCR durante el brote de ZIKV en Curazao y Bonaire.
De los 324 pacientes que presentaron muestras pareadas de orina entre diciembre de 2015 y octubre de 2016, 70 pacientes resultaron positivos en su primera muestra, mientras que solo 32 personas aún dieron positivo por qRT-PCR en su segunda muestra (Tabla 2), tomada entre 11 y 17 días después de la muestra inicial. Esto indica que para algunos pacientes en esta cohorte, el ARN del ZIKV aún era detectable en orina hasta 17 días después. Además, hubo una tendencia significativa en la disminución de la cantidad de virus excretado en la orina durante este período de tiempo (P < 0,0001, prueba t pareada) (Figura 1). No se encontraron diferencias significativas en la cantidad de virus excretado en la orina entre hombres y mujeres (datos no mostrados).
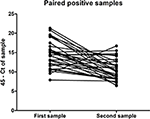 Figura 1. Cantidad de ARN de ZIKV detectado en la primera y segunda muestras de orina positivas para ZIKV de las muestras pareadas presentadas para análisis por 32 individuos, expresada en términos de umbral de CT 45 menos el CT determinado para la muestra.
Figura 1. Cantidad de ARN de ZIKV detectado en la primera y segunda muestras de orina positivas para ZIKV de las muestras pareadas presentadas para análisis por 32 individuos, expresada en términos de umbral de CT 45 menos el CT determinado para la muestra.
Durante el período del 17 de octubre de 2016 hasta el 26 de abril de 2017, también se recolectaron un total de 744 muestras de 382 individuos en Bonaire y se analizaron en MLS Curazao. De estas, 599 muestras pertenecientes a 358 pacientes fueron analizadas mediante qRT-PCR. Un total de 129 muestras correspondientes a 112 pacientes resultaron positivas por qRT-PCR para ZIKV. De los 262 pacientes que tenían tanto una muestra de suero como de orina tomada el mismo día, 183 tuvieron ambas muestras analizadas concomitantemente mediante qRT-PCR. De estos, 13 pacientes fueron positivos tanto para suero como para orina, mientras que 17 pacientes resultaron positivos solo para suero, y 18 solo para orina. Ciento treinta y cinco pacientes resultaron negativos para ambas (Tabla 2).
Para ambas islas, el número máximo de casos absolutos ocurrió en noviembre de 2016, con 247 casos confirmados por qRT-PCR en Curazao (Figura 2A) y 66 casos positivos por qRT-PCR en Bonaire (Figura 2C; Tabla 3). En términos de prevalencia, para Curazao, el pico (79%) también ocurrió en noviembre de 2016 (Figura 2B), mientras que para Bonaire la prevalencia máxima (50%) fue en octubre de 2016 (Figura 2D; Tabla 3). En general, se diagnosticó una mayor proporción de mujeres que de hombres (~73%) tanto en Curazao como en Bonaire (Tabla 4), con tasas de incidencia de 737 y 875 por 100.000, respectivamente. Además, el ZIKV se diagnosticó principalmente en individuos en la categoría de edad de 25-54 años tanto en Curazao (61%; tasa de incidencia de 863 por 100.000) como en Bonaire (67%; tasa de incidencia de 815 por 100.000) (Tabla 4).
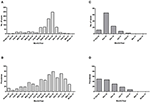 Figura 2. Número absoluto de casos y prevalencia de pacientes positivos para ZIKV confirmados por qRT-PCR en Curazao desde mediados de diciembre de 2015 hasta finales de abril de 2017 (A,B), y en Bonaire desde mediados de octubre de 2016 hasta finales de abril de 2017 (C,D).
Figura 2. Número absoluto de casos y prevalencia de pacientes positivos para ZIKV confirmados por qRT-PCR en Curazao desde mediados de diciembre de 2015 hasta finales de abril de 2017 (A,B), y en Bonaire desde mediados de octubre de 2016 hasta finales de abril de 2017 (C,D).
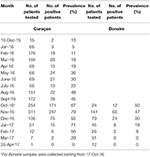 Tabla 3. Prevalencia mensual de pacientes positivos para ZIKV confirmados por qRT-PCR en Curazao y Bonaire durante el brote.
Tabla 3. Prevalencia mensual de pacientes positivos para ZIKV confirmados por qRT-PCR en Curazao y Bonaire durante el brote.
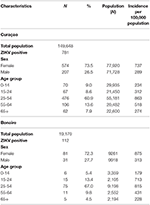 Tabla 4. Características de los 781 pacientes confirmados por qRT-PCR para infección por ZIKV en Curazao entre el 16 de diciembre de 2015 y el 26 de abril de 2017, y de los 112 pacientes confirmados en Bonaire entre el 17 de octubre de 2016 y el 26 de abril de 2017, según sexo y edad [con uso de datos demográficos de población de julio de 2017 (www.indexmundi.com)].
Tabla 4. Características de los 781 pacientes confirmados por qRT-PCR para infección por ZIKV en Curazao entre el 16 de diciembre de 2015 y el 26 de abril de 2017, y de los 112 pacientes confirmados en Bonaire entre el 17 de octubre de 2016 y el 26 de abril de 2017, según sexo y edad [con uso de datos demográficos de población de julio de 2017 (www.indexmundi.com)].
Para determinar la distribución de las infecciones por ZIKV en Curazao, se trazaron en un mapa de Curazao las ubicaciones de los pacientes que dieron positivo para ZIKV mediante qRT-PCR. No se pudieron localizar con precisión en el mapa las ubicaciones de 197 pacientes. El mapa muestra que la mayoría de los casos de ZIKV se concentraron en la parte oriental de la isla, particularmente en Willemstad (Figura 3). Las geozonas con un número notable de infecciones incluyeron Santa Rosa, Spaanse Water, St. Michiel, Dominguito, Brievengat, Berg Altena, Tera Cora, Stenen Koraal y Groot Piscadera.
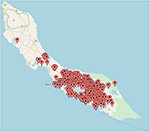 Figura 3. Las ubicaciones de una selección de los pacientes en Curazao que dieron positivo para ZIKV mediante qRT-PCR. El mapa se creó trazando las ubicaciones en www.mapcustomizer.com.
Figura 3. Las ubicaciones de una selección de los pacientes en Curazao que dieron positivo para ZIKV mediante qRT-PCR. El mapa se creó trazando las ubicaciones en www.mapcustomizer.com.
Discusión
A pesar de la emergencia documentada del ZIKV en las Américas en Brasil en mayo de 2015, los análisis filogenéticos estiman que la introducción del virus fue anterior, ya sea entre agosto de 2013 y julio de 2014 (38) o entre mayo y diciembre de 2013 (39). En Curazao, según nuestros análisis, los primeros casos de ZIKV se diagnosticaron en diciembre de 2015, un mes antes de la primera notificación a la OMS el 28 de enero de 2016 (24), lo que indica que el virus, probablemente introducido por viajeros, surgió antes de lo oficialmente reportado. Dada la rápida propagación del virus por las Américas tras su aparición en Brasil, Curazao y Bonaire no estaban preparados para un brote de ZIKV, y por lo tanto, las pruebas diagnósticas aún no se habían implementado ni validado en MLS. Este problema se solucionó enviando muestras de pacientes al laboratorio de diagnóstico del EMC en los Países Bajos, un Centro Colaborador de la OMS para arbovirus. A partir de octubre de 2016, MLS Curazao había implementado las pruebas comerciales de diagnóstico qRT-PCR y ELISA necesarias para continuar con el diagnóstico de pacientes con sospecha de ZIKV en Curazao y comenzar con los diagnósticos para Bonaire. Cabe destacar que este estudio no fue diseñado prospectivamente, sino que se realizó en reacción a una situación de brote dinámica.
Durante este período, también se realizó un cambio de orina a suero para las muestras recolectadas en Curazao. Aunque algunos estudios han demostrado que la orina era más sensible para la detección de ZIKV mediante qRT-PCR en comparación con el suero (30, 31), los datos de las muestras pareadas de suero y orina de Bonaire sugieren que en esta cohorte, estas dos matrices eran necesarias concomitantemente para aumentar la probabilidad de detección del ZIKV. Como resultado, es posible que se hayan pasado por alto muchos casos de ZIKV tanto en Curazao como en Bonaire, ya que aquí no se recolectaron ni analizaron sistemáticamente muestras pareadas de orina y suero en qRT-PCR. Aunque muchas muestras PCR-negativas de Curazao y Bonaire también se habían analizado en ELISA IgM/IgG, la reactividad cruzada conocida que ocurre entre los anticuerpos del ZIKV y el DENV dificulta el diagnóstico basado en serología (36, 37) y podría conducir fácilmente a falsos positivos. Como resultado, los datos serológicos de muestras de pacientes recolectadas 14 días después del inicio de los síntomas no se incluyeron en nuestros análisis, y por lo tanto, nuestros resultados son muy probablemente una subestimación del número de casos de ZIKV en ambas islas. Otro factor que puede haber llevado a una subestimación del número total de casos es el hecho de que no todos los individuos que experimentaron síntomas acudieron al médico general para hacerse la prueba. Además, en Curazao, tres laboratorios estuvieron involucrados en las pruebas diagnósticas de pacientes con ZIKV, a saber, MLS, Analytisch Diagnostisch Centrum (ADC) y Laboratorio de Medicos (LabdeMed). Si se combinaran todos los datos, el número total de casos de ZIKV probablemente sería mucho mayor que el presentado en este artículo.
El pico del brote de ZIKV en Curazao pareció ocurrir en noviembre de 2016, tanto en términos del número absoluto de casos como de prevalencia. Para Bonaire, el pico en el número absoluto de casos pareció ocurrir también en noviembre de 2016, mientras que en términos de prevalencia pareció ocurrir en octubre de 2016. Sin embargo, como no se realizaron diagnósticos de ZIKV para Bonaire entre mediados de diciembre de 2015 y mediados de octubre de 2016, los datos de octubre no son fiables para comparar con los otros meses, y tampoco se puede excluir que un mayor número de personas en Bonaire pudiera haberse infectado en uno de los meses anteriores a noviembre.
Es interesante destacar que, durante el brote reportado de ZIKV en Curazao y Bonaire, no se informaron casos de microcefalia ni fallecimientos debido al ZIKV. No obstante, asumiendo un riesgo de microcefalia similar del 0,02% para mujeres embarazadas, como se calculó para Brasil (40), y una tasa de fertilidad de aproximadamente 2,1 para Curazao [basado en datos de 2011 (41)], lo que equivale a aproximadamente 2.100 nacimientos vivos por año, esto habría resultado en 0,42 casos de microcefalia durante el brote en Curazao (que duró aproximadamente un año). Por lo tanto, no es sorprendente que no se hayan observado casos de microcefalia relacionados con el ZIKV en una población de solo 150.000 y 19.000 habitantes.
Durante el brote de ZIKV tanto en Curazao como en Bonaire, casi tres veces más mujeres que hombres fueron infectadas con el virus. Las infecciones ocurrieron principalmente en la categoría de edad de 25 a 54 años tanto para hombres como para mujeres. Esta mayor proporción de infecciones femeninas durante un brote de ZIKV también se reportó en Surinam (42) y Río de Janeiro en Brasil (43). Esta tasa de infección desproporcionada puede explicarse por el aumento de las pruebas en mujeres embarazadas debido a las preocupaciones sobre la microcefalia y otros riesgos para los fetos. Sin embargo, tal tendencia también se demostró en Río de Janeiro durante un brote de DENV (43), donde las mujeres tenían un 30% más de probabilidades de ser diagnosticadas con DENV que los hombres. Una explicación sugerida por este estudio fue que las mujeres son más conscientes de su salud y, por lo tanto, más propensas a visitar a un médico general. No obstante, otra posibilidad, como también se especuló en el estudio de Coelho (43), es que para el ZIKV, ocurra una mayor cantidad de transmisiones sexuales de hombre a mujer en comparación con las transmisiones de mujer a hombre. Ya se ha demostrado la infección de mujeres por ZIKV a través del semen (1–3), y aunque el ZIKV también se ha detectado en el tracto genital femenino y las secreciones vaginales (44–47), aún no se ha demostrado la capacidad del virus para infectar productivamente a los hombres a través de las secreciones vaginales durante el coito. Además, también se debe investigar la influencia de las hormonas reproductivas femeninas en la replicación y transmisión del ZIKV, ya que recientemente se ha demostrado que los progestágenos promueven la infección por VIH en el tracto reproductivo femenino de primates no humanos (48).
Con el fin de obtener una impresión de la distribución del número de casos de ZIKV en Curazao, se trazaron las ubicaciones de los pacientes en un mapa. La mayoría de los casos se localizaron en el este de la isla, lo que puede ser el resultado de un sesgo de notificación causado por una mayor densidad poblacional en el este (Willemstad) (41). No obstante, para las geozonas que contenían la mayor cantidad de casos de ZIKV, no se identificó ninguna tendencia particular en términos de densidad poblacional o ingreso mensual bruto promedio por hogar (datos no mostrados). Es posible que la distribución geoespacial de los casos de ZIKV sea un reflejo de la presencia de mosquitos infectados con ZIKV; sin embargo, dado que muchos habitantes de Curazao viajan a diferentes partes de la isla diariamente, no es posible determinar con certeza la ubicación de la transmisión. Además de la transmisión por mosquitos, la transmisión sexual del ZIKV también puede haber influido en la distribución geoespacial de los casos en la isla.
Conclusiones
Dado que Curazao y Bonaire son (potenciales) focos de infecciones arbovirales emergentes y reemergentes, es importante que las islas estén preparadas para futuros brotes implementando las herramientas diagnósticas apropiadas con antelación. Sin embargo, además de diagnósticos efectivos, es imperativo que también se establezca la infraestructura adecuada para permitir la comunicación durante un escenario de brote y facilitar la implementación de actividades de reducción de riesgos con el fin de hacer frente a cualquier enfermedad infecciosa que pueda surgir en el futuro.
Declaración de Disponibilidad de Datos
Los conjuntos de datos generados y/o analizados durante el presente estudio no están disponibles públicamente debido a los derechos de privacidad de los pacientes, pero una selección de conjuntos de datos está disponible por parte del autor correspondiente bajo solicitud razonable.
Declaración Ética
Se obtuvo el consentimiento por escrito de cada individuo que proporcionó muestras de orina, suero o plasma. El consentimiento para los menores de 16 años fue proporcionado por sus padres o tutores. Dado que MLS y el departamento de Virociencia están autorizados para proporcionar apoyo de laboratorio para investigaciones de brotes, no se buscó autorización ética adicional.
Contribuciones de los Autores
RW, SP y GB coordinaron y supervisaron los diagnósticos de laboratorio y la logística. SL, SP y GB estuvieron involucrados en los análisis. SL, SP, MK y BM redactaron el manuscrito.
Financiación
La investigación que condujo a estos resultados ha recibido financiación de COMPARE (Horizon 2020 de la Unión Europea, Acuerdo de Subvención No. 643476), ZikaRisk (Proyecto NWO ZonMW No. 522003001) y ZIKAlliance (Horizon 2020 de la Unión Europea, Acuerdo de Subvención No. 734548). Los financiadores no tuvieron ningún papel en el diseño del estudio, la recolección y análisis de datos, la decisión de publicar o la preparación del manuscrito.
Conflicto de Intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Deseamos expresar nuestro agradecimiento a todo el personal de laboratorio y miembros del personal de MLS y del departamento de Virociencia por sus contribuciones técnicas y organizativas.
Abreviaturas
ZIKV, virus del Zika; DENV, virus del dengue; CHIKV, virus del chikungunya; IgM, inmunoglobulina M; IgG, inmunoglobulina G; ELISA, ensayo por inmunoabsorción ligado a enzimas; qRT-PCR, reacción en cadena de la polimerasa cuantitativa en tiempo real; RNA, ácido ribonucleico; EDTA, ácido etilendiaminotetraacético; WHO, Organización Mundial de la Salud; NAT, prueba de ácidos nucleicos; MLS, Servicios de Laboratorio Médico; EMC, Centro Médico Erasmus; NS2A, proteína no estructural 2A; PDV, virus del moquillo de las focas; CT, umbral de ciclo; FTD, Fast Track Diagnostics; ADC, Analytisch Diagnostisch Centrum; HIV, virus de la inmunodeficiencia humana.
Referencias
1. Foy BD, Kobylinski KC, Chilson Foy JL, Blitvich BJ, Travassos da Rosa A, Haddow AD, et al. Probable transmisión no vectorial del virus del Zika, Colorado, EE. UU. Emerg Infect Dis. (2011) 17:880–2. doi: 10.3201/eid1705.101939
2. Hills SL, Russell K, Hennessey M, Williams C, Oster AM, Fischer M, et al. Transmisión del virus del Zika a través del contacto sexual con viajeros a áreas de transmisión continua – Estados Unidos continental, 2016. MMWR Morb Mortal Wkly Rep. (2016) 65:215–6. doi: 10.15585/mmwr.mm6508e2
3. D’Ortenzio E, Matheron S, Yazdanpanah Y, de Lamballerie X, Hubert B, Piorkowski G, et al. Evidencia de transmisión sexual del virus del Zika. N Engl J Med. (2016) 374:2195–8. doi: 10.1056/NEJMc1604449
4. Calvet G, Aguiar RS, Melo ASO, Sampaio SA, de Filippis I, Fabri A, et al. Detección y secuenciación del virus del Zika en líquido amniótico de fetos con microcefalia en Brasil: un estudio de caso. Lancet Infect Dis. (2016) 16:653–60. doi: 10.1016/S1473-3099(16)00095-5
5. Galán-Huerta KA, Rivas-Estillaa AM, Martinez-Landerosb EA, Arellanos-Sotoab D, Ramos-Jiménez J. La enfermedad del virus del Zika: una visión general. Med Univ. (2016) 18:115–24. doi: 10.1016/j.rmu.2016.05.003
7. Cao-Lormeau VM, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, et al. Brote del síndrome de Guillain-Barré asociado con la infección por el virus del Zika en la Polinesia Francesa: un estudio de casos y controles. Lancet. (2016) 387:1531–9. doi: 10.1016/S0140-6736(16)00562-6
8. Roze B, Najioullah F, Fergé JL, Dorléans F, Apetse K, Barnay JL, et al. Síndrome de Guillain-Barré asociado con la infección por el virus del Zika en Martinica en 2016: un estudio prospectivo. Clin Infect Dis. (2017) 65:1462–8. doi: 10.1093/cid/cix588
10. Araujo LM, Ferreira ML, Nascimento OJ. Síndrome de Guillain-Barré asociado al brote del virus del Zika en Brasil. Arq Neuropsiquiatr. (2016) 74:253–5. doi: 10.1590/0004-282X20160035
11. Yepez JB, Murati FA, Pettito M, Peñaranda CF, de Yepez J, Maestre G, et al. Manifestaciones oftalmológicas del síndrome congénito del Zika en Colombia y Venezuela. JAMA Ophthalmol. (2017) 135:440–5. doi: 10.1001/jamaophthalmol.2017.0561
12. Kodati S, Palmore TN, Spellman FA, Cunningham D, Weistrop B, Sen HN. Uveítis posterior bilateral asociada a la infección por el virus del Zika. Lancet. (2017) 389:125–6. doi: 10.1016/S0140-6736(16)32518-1
13. Wong CW, Ng SR, Cheung CMG, Wong TY, Mathur R. Maculopatía relacionada con el Zika. Retin Cases Brief Rep. (2019) 13:171–3. doi: 10.1097/ICB.0000000000000552
14. Miranda-Filho DDB, Martelli CM, Ximenes RA, Araújo TV, Rocha MA, Ramos RC, et al. Descripción inicial del presunto síndrome congénito del Zika. Am J Public Health. (2016) 106:598–600. doi: 10.2105/AJPH.2016.303115
15. de Araujo TVB, Rodrigues LC, de Alencar Ximenes RA, de Barros Miranda-Filho D, Montarroyos UR, de Melo APL, et al. Asociación entre la infección por el virus del Zika y la microcefalia en Brasil, de enero a mayo de 2016: informe preliminar de un estudio de casos y controles. Lancet Infect Dis. (2016) 16:1356–63. doi: 10.1016/S1473-3099(16)30318-8
16. Rubin EJ, Greene MF, Baden LR. Virus del Zika y microcefalia. N Engl J Med. (2016) 374:984–5. doi: 10.1056/NEJMe1601862
17. Honein MA, Dawson AL, Petersen EE, Jones AM, Lee EH, Yazdy MM, et al. Defectos congénitos entre fetos y lactantes de mujeres estadounidenses con evidencia de posible infección por el virus del Zika durante el embarazo. JAMA. (2017) 317:59–68. doi: 10.1001/jama.2016.19006
18. Brasil P, Pereira JP Jr, Moreira ME, Ribeiro Nogueira RM, Damasceno L, Wakimoto M, et al. Infección por el virus del Zika en mujeres embarazadas en Río de Janeiro. N Engl J Med. (2016) 375:2321–34. doi: 10.1056/NEJMoa1602412
19. Duffy MR, Chen TH, Hancock WT, Powers AM, Kool JL, Lanciotti RS, et al. Brote del virus del Zika en la Isla de Yap, Estados Federados de Micronesia. N Engl J Med. (2009) 360:2536–43. doi: 10.1056/NEJMoa0805715
20. Roth A, Mercier A, Lepers C, Hoy D, Duituturaga S, Benyon E, et al. Brotes concurrentes de infecciones por los virus del dengue, chikungunya y Zika – una ola epidémica sin precedentes de virus transmitidos por mosquitos en el Pacífico 2012-2014. Euro Surveill. (2014) 19:20929. doi: 10.2807/1560-7917.ES2014.19.41.20929
21. Tognarelli J, Ulloa S, Villagra E, Lagos J, Aguayo C, Fasce R, et al. Informe sobre el brote del virus del Zika en la Isla de Pascua, Pacífico Sur, 2014. Arch Virol. (2016) 161:665–8. doi: 10.1007/s00705-015-2695-5
22. Dupont-Rouzeyrol M, O’Connor O, Calvez E, Daurès M, John M, Grangeon JP, et al. Coinfección con los virus del Zika y del dengue en 2 pacientes, Nueva Caledonia, 2014. Emerg Infect Dis. (2015) 21:381–2. doi: 10.3201/eid2102.141553
23. Fauci AS, Morens DM. Zika virus en las Américas–otra amenaza arboviral más. N Engl J Med. (2016) 374:601–4. doi: 10.1056/NEJMp1600297
24. Kindhauser MK, Allen T, Frank V, Santhana RS, Dye C. Zika: el origen y la propagación de un virus transmitido por mosquitos. Bull World Health Organ. (2016) 94:675–86C. doi: 10.2471/BLT.16.171082
25. Organización Panamericana de la Salud/Organización Mundial de la Salud. Cronología de la emergencia del virus del Zika en las Américas. Washington, DC: Organización Panamericana de la Salud/Organización Mundial de la Salud (2016).
26. Ministério da Saúde. Protocolo de vigilância e resposta à ocorrência de microcefalia relacionada à infecção pelo vírus Zika. Brasília: Departamento de Vigilância das Doenças Transmissíveis, Núcleo de Comunicação/SVS (2015).
27. Organización Panamericana de la Salud/Organización Mundial de la Salud. PLISA: Plataforma de Información en Salud para las Américas – Casos Reportados de Dengue en las Américas. Organización Panamericana de la Salud/Organización Mundial de la Salud. Disponible en: http://www.paho.org/data/index.php/en/mnu-topics/indicadores-dengue-en/dengue-nacional-en/252-dengue-pais-ano-en.html (consultado el 19 de julio de 2018).
28. Organización Panamericana de la Salud/Organización Mundial de la Salud. Número de Casos Reportados de Fiebre Chikungunya en las Américas, por País o Territorio 2013-2014, Casos Acumulados, SE 49. (2014). Disponible en: https://www.paho.org/hq/dmdocuments/2014/2014-dec-05-cha-chikungunya-cases-ew-49.pdf (consultado el 14 de noviembre de 2018).
29. Lanciotti RS, Kosoy OL, Laven JJ, Velez JO, Lambert AJ, Johnson AJ, et al. Propiedades genéticas y serológicas del virus del Zika asociado con una epidemia, Estado de Yap, Micronesia, 2007. Emerg Infect Dis. (2008) 14:1232–9. doi: 10.3201/eid1408.080287
30. Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Detección del virus del Zika en orina. Emerg Infect Dis. (2015) 21:84–6. doi: 10.3201/eid2101.140894
31. Lamb LE, Bartolone SN, Kutluay SB, Robledo D, Porras A, Plata M, et al. Ventaja del diagnóstico molecular del virus del Zika basado en orina. Int Urol Nephrol. (2016) 48:1961–6. doi: 10.1007/s11255-016-1406-9
32. Lustig Y, Mendelson E, Paran N, Melamed S, Schwartz E. Detección de ARN del virus del Zika en sangre completa de casos importados de enfermedad por virus del Zika hasta 2 meses después del inicio de los síntomas, Israel, diciembre de 2015 a abril de 2016. Euro Surveill. (2016) 21:30269. doi: 10.2807/1560-7917.ES.2016.21.26.30269
33. Organización Mundial de la Salud. Pruebas de laboratorio para la infección por el virus de Zika, WHO/ZIKV/LAB/16.1 (2016).
34. Ferreira-de-Brito A, Ribeiro IP, Miranda RM, Fernandes RS, Campos SS, Silva KA, et al. Primera detección de infección natural de Aedes aegypti con el virus del Zika en Brasil y en toda América del Sur. Mem Inst Oswaldo Cruz. (2016) 111:655–8. doi: 10.1590/0074-02760160332
35. Hoek RA, Paats MS, Pas SD, Bakker M, Hoogsteden HC, Boucher CA, et al. Incidencia de patógenos respiratorios virales que causan exacerbaciones en pacientes adultos con fibrosis quística. Scand J Infect Dis. (2013) 45:65–9. doi: 10.3109/00365548.2012.708942
36. Priyamvada L, Quicke KM, Hudson WH, Onlamoon N, Sewatanon J, Edupuganti S, et al. Las respuestas de anticuerpos humanos después de la infección por el virus del dengue son altamente reactivas de forma cruzada al virus del Zika. Proc Natl Acad Sci USA. (2016) 113:7852–7. doi: 10.1073/pnas.1607931113
37. Felix AC, Souza NCS, Figueiredo WM, Costa AA, Inenami M, da Silva RMG, et al. Reactividad cruzada de inmunoensayos comerciales contra el dengue en pacientes con infección aguda por el virus del Zika. J Med Virol. (2017) 89:1477–9. doi: 10.1002/jmv.24789
38. Metsky HC, Matranga CB, Wohl S, Schaffner SF, Freije CA, Winnicki SM, et al. Evolución y propagación del virus del Zika en las Américas. Nature. (2017) 546:411–5. doi: 10.1038/nature22402
39. Faria NR, Azevedo RDSDS, Kraemer MUG, Souza R, Cunha MS, Hill SC, et al. El virus del Zika en las Américas: hallazgos epidemiológicos y genéticos tempranos. Science. (2016) 352:345–9. doi: 10.1126/science.aaf5036
40. Jaenisch T, Rosenberger KD, Brito C, Brady O, Brasil P, Marques ETA. Riesgo de microcefalia tras la infección por el virus del Zika en Brasil, 2015 a 2016. Bull World Health Organ. (2017) 95:191–8. doi: 10.2471/BLT.16.178608
41. Ter Bals M. Demografía de Curazao – Serie de Publicaciones del Censo 2011. Willemstad: Oficina Central de Estadísticas (2014).
42. Codrington J, Roosblad J, Baidjoe A, Holband N, Adde A, Kazanji M, et al. Brote del virus del Zika en Surinam, un informe basado en datos de vigilancia de laboratorio. PLoS Curr. (2018) 10. doi: 10.1371/currents.outbreaks.ff0f6190d5431c2a2e824255eaeaf339
43. Coelho FC, Durovni B, Saraceni V, Lemos C, Codeco CT, Camargo S, et al. La mayor incidencia del Zika en mujeres adultas que en hombres adultos en Río de Janeiro sugiere una contribución significativa de la transmisión sexual de hombres a mujeres. Int J Infect Dis. (2016) 51:128–32. doi: 10.1016/j.ijid.2016.08.023
44. Penot P, Brichler S, Guilleminot J, Lascoux-Combe C, Taulera O, Gordien E, et al. Virus del Zika infeccioso en secreciones vaginales de una mujer infectada con VIH, Francia, agosto de 2016. Euro Surveill. (2017) 22:30444. doi: 10.2807/1560-7917.ES.2017.22.3.30444
45. Murray KO, Gorchakov R, Carlson AR, Berry R, Lai L, Natrajan M, et al. Detección prolongada del virus del Zika en secreciones vaginales y sangre completa. Emerg Infect Dis. (2017) 23:99–101. doi: 10.3201/eid2301.161394
46. Tang WW, Young MP, Mamidi A, Regla-Nava JA, Kim K, Shresta S. Un modelo murino de transmisión sexual del virus del Zika y replicación viral vaginal. Cell Rep. (2016) 17:3091–8. doi: 10.1016/j.celrep.2016.11.070
47. Sanchez-Montalva A, Pou D, Sulleiro E, Salvador F, Bocanegra C, Treviño B, et al. Dinámica del virus del Zika en fluidos corporales y riesgo de transmisión sexual en un área no endémica. Trop Med Int Health. (2018) 23:92–100. doi: 10.1111/tmi.13019
48. Carias AM, Allen SA, Fought AJ, Kotnik Halavaty K, Anderson MR, Jimenez ML, et al. Los aumentos en progestinas endógenas o exógenas promueven las interacciones entre virus y células diana dentro del tracto reproductivo femenino de primates no humanos. PLoS Pathog. (2016) 12:e1005885. doi: 10.1371/journal.ppat.1005885
Palabras clave: virus del Zika, brote, laboratorio, qRT-PCR, epidemiología, Curazao, Bonaire
Citación: Lim SM, Wever R, Pas SD, Bonofacio G, Koopmans MPG y Martina BEE (2019) Brote del Virus del Zika en Curazao y Bonaire, un Informe Basado en Datos de Diagnóstico de Laboratorio. Front. Public Health 7:333. doi: 10.3389/fpubh.2019.00333
Recibido: 11 de junio de 2019; Aceptado: 25 de octubre de 2019;
Publicado: 12 de noviembre de 2019.
Editado por:
Matthew H. Collins, Universidad de Emory, Estados Unidos
Revisado por:
Man-Qing Liu, Centro de Prevención y Control de Enfermedades de Wuhan, China
José Eduardo Levi, Universidad de São Paulo, Brasil
Copyright © 2019 Lim, Wever, Pas, Bonofacio, Koopmans y Martina. Este es un artículo de acceso abierto distribuido bajo los términos de la Licencia de Atribución Creative Commons (CC BY). Se permite el uso, distribución o reproducción en otros foros, siempre que se acredite al autor o autores originales y al titular o titulares de los derechos de autor, y que la publicación original en esta revista sea citada, de acuerdo con la práctica académica aceptada. No se permite ningún uso, distribución o reproducción que no cumpla con estos términos.
*Correspondencia: Stephanie M. Lim, [email protected]