Stephanie M. Lim1*,
Stephanie M. Lim1*,  Robert Wever2,
Robert Wever2,  Suzan D. Pas3,
Suzan D. Pas3,  Gygliola Bonofacio2,
Gygliola Bonofacio2,  Marion P. G. Koopmans3 en
Marion P. G. Koopmans3 en  Byron E. E. Martina1,3
Byron E. E. Martina1,3- 1Artemis One Health Research Foundation, Delft, Nederland
- 2Medical Laboratory Services, Willemstad, Curaçao
- 3Afdeling Virologie, WHO Collaborating Centre for Arboviruses and Hemorrhagic Fevers, Erasmus Medisch Centrum, Rotterdam, Nederland
Achtergrond: Het Zikavirus (ZIKV) dook op in mei 2015 in Brazilië, vanwaar het zich verspreidde naar veel andere landen in Latijns-Amerika. Uiteindelijk werden er ook gevallen van ZIKV-infectie gemeld op Curaçao (januari 2016) en Bonaire (februari 2016).
Methoden: In de periode van 16 december 2015 tot 26 april 2017 werden serum-, EDTA-plasma- of urinemonsters afgenomen bij Medical Laboratory Services (MLS) van patiënten op Curaçao en getest met qRT-PCR in het Erasmus Medisch Centrum (EMC) in Nederland. Tussen 17 oktober 2016 en 26 april 2017 werden alle monsters van verdachte ZIKV-patiënten verzameld op Curaçao en Bonaire getest bij MLS. Gepaarde urine- en/of serummonsters van patiënten werden geanalyseerd op ZIKV-uitscheidingskinetiek en vergeleken qua gevoeligheid voor ZIKV RNA-detectie. Verder werden de leeftijd en het geslacht van patiënten gebruikt om ZIKV-incidentiecijfers te bepalen, en hun geozone-locatie om de ruimtelijke verdeling van ZIKV-gevallen te bepalen.
Resultaten: In totaal werden 781 patiënten van 2820 geteste personen qRT-PCR-positief bevonden voor ZIKV op Curaçao. De eerste twee ZIKV-gevallen werden gediagnosticeerd in december 2015. In totaal testten 112 patiënten van 382 onderzochte personen qRT-PCR-positief voor ZIKV op Bonaire. Voor beide eilanden vond het hoogste aantal absolute gevallen plaats in november 2016, met 247 qRT-PCR-bevestigde gevallen op Curaçao en 66 qRT-PCR-positieve gevallen op Bonaire. Over het algemeen werd een hoger percentage vrouwen dan mannen gediagnosticeerd met ZIKV op beide eilanden, evenals voornamelijk personen in de leeftijdscategorie van 25-54 jaar. Bovendien waren ZIKV-gevallen voornamelijk geclusterd in het oosten van het eiland, in Willemstad.
Conclusies: Door qRT-PCR bevestigde ZIKV-gevallen geven aan dat het virus op Curaçao circuleerde tussen ten minste december 2015 en maart 2017, en op Bonaire tussen ten minste oktober 2016 en februari 2017, met piekgevallen in november 2016. Het gebrek aan paraatheid van Curaçao voor de ZIKV-uitbraak werd gecompenseerd door alle monsters naar het EMC te sturen voor diagnostische tests; beide eilanden zullen echter de juiste infrastructuur moeten opzetten om in de toekomst snel te kunnen reageren op een uitbraak van een nieuw opkomend virus.
Intro
Het Zikavirus (ZIKV) is een arbovirus dat behoort tot de Flaviviridae-familie, genus Flavivirus, en wordt overgedragen door de beet van geïnfecteerde Aedes aegypti-muggen, via seksueel contact (1–3), of van moeder op foetus (4). ZIKV-infectie is vaak asymptomatisch of presenteert zich anders met milde symptomen zoals koorts, maculopapulaire uitslag, conjunctivitis, spierpijn en hoofdpijn (5). In een klein aantal gevallen kan ZIKV-infectie resulteren in ernstige complicaties zoals het Guillain-Barré-syndroom (6–10), maculopathie (11–13), of microcefalie bij pasgeborenen wanneer de moeder tijdens de zwangerschap met het virus is geïnfecteerd (14–18).
Yo, check dit uit. Sinds ze die ZIKV in ’47 in Uganda ontdekten, bleef dat ding chillen in Afrika en veroorzaakte het alleen af en toe wat milde shit. Maar in 2007 ging het los op Yap, waar zo’n 73% van de peeps besmet raakte en 18% ziek werd. Daarna spreidde die shit zich als een malle over de Stille Oceaan, met uitbraken in Frans-Polynesië, de Cookeilanden, Paaseiland en Nieuw-Caledonië. Uiteindelijk belandde het in Amerika. Eerst in Brazilië in mei 2015, en daarna in allerlei andere Latijns-Amerikaanse landen. In Brazilië alleen al raakten tussen de 440.000 en 1,3 miljoen mensen besmet in 2015, en er zijn zo’n 2366 gevallen van ZIKV-gerelateerde microcefalie gemeld. Die shit blijft zich maar verspreiden, en we weten nog steeds niet precies hoeveel mensen en kinderen er in totaal geraakt zijn.
Curaçao, met z’n bijna 150.000 inwoners, staat bekend om virussen die door A. aegypti muggen worden overgedragen, zoals dengue en chikungunya. Dengue hangt daar al eeuwen rond en breekt om de zoveel jaar uit. De laatste keer was in 2014, toen er eind augustus 194 verdachte en 20 bevestigde gevallen waren (27). In juni van dat jaar dook ook het eerste geval van chikungunya op, wat leidde tot een grote uitbraak die tot februari 2015 duurde. Eind november 2014 waren er al 1.838 verdachte en 835 bevestigde gevallen van chikungunya (28). Op Bonaire, met zo’n 19.000 inwoners, is dengue ook een ding, maar daar hoor je niet zoveel over.
Yo, het bevestigen van een infectie is een bitch vanwege de serologische kruisreactiviteit tussen flavivirussen. IgM tegen ZIKV opsporen met ELISA is een optie, maar er is kruisreactiviteit tussen DENV en ZIKV IgM aangetoond (29). Dus je hebt alsnog neutralisatietests nodig om het zeker te weten. Daarom gebruiken ze meestal qRT-PCR om viraal RNA in serum te vinden. Maar bij veel arbovirussen zoals DENV of ZIKV is er vaak maar weinig virus in het bloed tijdens de symptomatische fase, wat de detectie lastig maakt. Urine bleek een goed alternatief voor het opsporen van ZIKV RNA, omdat er meer RNA in zit en het langer positief blijft na het begin van de symptomen (>10-20 dagen) (30, 31). Maar een andere studie toonde aan dat ZIKV langer in volbloed aanwezig blijft dan in urine en serum (32). De WHO raadt daarom aan om volbloed, serum of urine te gebruiken voor nucleïnezuurtests, en serum voor IgM-detectie (33). Ze zeggen dat routinematige bevestiging van serologische resultaten met virusneutralisatietests niet haalbaar is.
Om te checken hoe erg de ZIKV-uitbraak op Curaçao en Bonaire was, hebben we gekeken naar het aantal bevestigde ZIKV-gevallen met qRT-PCR, hoe vaak het voorkwam bij patiënten van verschillende leeftijden en geslachten, en waar de ZIKV-gevallen op Curaçao precies waren. We hebben ook gepaarde urinemonsters van Curaçao onderzocht om te zien hoe ZIKV zich daar ontwikkelde, en gepaarde urine- en serummonsters van Bonaire vergeleken om te kijken hoe goed we ZIKV RNA konden opsporen.
Methodes
Yo, tussen 16 december 2015 en 26 april 2017 hebben ze bij Medical Laboratory Services (MLS) op Curaçao bloed, plasma of plas gepakt van mensen die ziek leken van het Zika-virus. Je weet wel, met koorts, uitslag, koppijn of ontstoken ogen. Van 16 december 2015 tot 15 oktober 2016 hebben ze die samples onschadelijk gemaakt en naar Rotterdam gestuurd. Daar hebben ze in het ziekenhuis met een speciale PCR-test gekeken of er Zika-virus in zat. Ze hebben twee verschillende stukjes van het virus geprobeerd te vinden. Als de test boven de 45 CT uitkwam, was het positief. Vanaf 6 juli 2016 hebben ze maar één stukje virus meer getest.
In het begin wisten ze nog niet zeker wat mensen precies hadden, dus in december 2015 en januari 2016 hebben ze ook getest op dengue en chikungunya. Van december 2015 tot oktober 2016 hebben ze twee keer plas (of bloed als ze geen plas hadden) getest met ongeveer twee weken ertussen. Vanaf februari 2016 kozen ze voor plas, of bloed als ze geen plas konden krijgen.
Van 17 oktober 2016 tot 26 april 2017 konden ze op Curaçao zelf testen. Ze hebben toen ook mensen op Bonaire getest. Daar namen ze op dezelfde dag bloed én plas af. Ze gebruikten PCR en/of antilichaamtests. Afhankelijk van hoe lang iemand al ziek was, kozen ze welke test ze deden. Maar omdat die antilichaamtests niet zo betrouwbaar zijn in gebieden waar ook dengue voorkomt, hebben we voor onze analyses alleen de PCR-resultaten gebruikt (36, 37).
Van 17 oktober tot 8 november 2016 testten ze plasma, maar daarna kozen ze voor gewoon bloed omdat dat makkelijker is (33).
Ze hebben Curaçao in 65 stukjes verdeeld en op een kaart laten zien waar de zieke mensen woonden. Ze hebben ook gekeken naar leeftijd en of het mannen of vrouwen waren. Ze gebruikten www.mapcustomizer.com.
De dokters hadden niet goed opgeschreven welke klachten mensen precies hadden en hoe lang al, dus dat konden we niet meenemen. Iedereen die getest werd moest toestemming geven, en voor kinderen onder de 16 deden hun ouders dat. Omdat de tests gewoon voor de diagnose waren, hoefden we geen extra goedkeuring te vragen voor dit onderzoek.
Statistieken
We hebben de dubbele samples vergeleken met een speciale test. Als de P-waarde 0,5 of lager was, vonden we het belangrijk.
Resultaten
Yo, tussen 16 december 2015 en 26 april 2017 hebben ze op Curaçao 3.833 samples van 2.820 mensen verzameld bij MLS. Van die samples hebben ze d’r 2.044 getest met qRT-PCR, van 1.685 patiënten. Dat leverde 815 positieve samples op, van 781 positieve ZIKV-patiënten (Tabel 2). Ze begonnen in december 2015 met het testen van serumsamples van ZIKV-verdachte patiënten op Curaçao, toen testten twee patiënten positief voor ZIKV met qRT-PCR. In de eerste twee maanden van de uitbraak (december 2015 en januari 2016), toen ze serumsamples ook testten op DENV en CHIKV met qRT-PCR, bleken vier van de 87 ZIKV-verdachte gevallen eigenlijk positief voor DENV (CT 26.6, 14.5, 29.5, en 34.4).
 Tabel 2. Aantal verzamelde en geteste samples, en het aantal patiënten getest met qRT-PCR tijdens de ZIKV-uitbraak op Curaçao en Bonaire.
Tabel 2. Aantal verzamelde en geteste samples, en het aantal patiënten getest met qRT-PCR tijdens de ZIKV-uitbraak op Curaçao en Bonaire.
Van de 324 patiënten die tussen december 2015 en oktober 2016 twee keer urine inleverden, testten er 70 positief op hun eerste sample, maar slechts 32 waren nog steeds qRT-PCR-positief op hun tweede sample (Tabel 2), afgenomen tussen 11 en 17 dagen na de eerste. Dat betekent dat bij sommige patiënten in deze groep ZIKV RNA nog tot 17 dagen in de urine te vinden was. Er was ook een duidelijke afname in de hoeveelheid virus in de urine over deze periode (P < 0.0001, gepaarde t-test) (Figuur 1). Er waren geen grote verschillen tussen mannen en vrouwen in de hoeveelheid virus in de urine (data niet getoond).
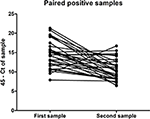 Figuur 1. Hoeveelheid ZIKV RNA gevonden in de eerste en tweede ZIKV-positieve urinesamples van de gepaarde samples ingeleverd door 32 mensen, uitgedrukt als CT drempelwaarde 45 min de CT bepaald voor het sample.
Figuur 1. Hoeveelheid ZIKV RNA gevonden in de eerste en tweede ZIKV-positieve urinesamples van de gepaarde samples ingeleverd door 32 mensen, uitgedrukt als CT drempelwaarde 45 min de CT bepaald voor het sample.
Van 17 oktober 2016 tot 26 april 2017 zijn er ook 744 samples verzameld van 382 mensen op Bonaire en getest bij MLS Curaçao. Daarvan zijn 599 samples van 358 patiënten getest met qRT-PCR. In totaal waren 129 samples van 112 patiënten qRT-PCR-positief voor ZIKV. Van de 262 patiënten die zowel een serum- als urinesample op dezelfde dag hadden ingeleverd, werden er bij 183 beide samples tegelijk getest met qRT-PCR. Daarvan waren 13 patiënten positief voor beide, 17 alleen positief voor serum, en 18 alleen voor urine. 135 patiënten waren negatief voor beide (Tabel 2).
Op beide eilanden was het hoogste aantal absolute gevallen in november 2016, met 247 qRT-PCR bevestigde gevallen op Curaçao (Figuur 2A) en 66 qRT-PCR-positieve gevallen op Bonaire (Figuur 2C; Tabel 3). Qua prevalentie was de piek voor Curaçao (79%) ook in november 2016 (Figuur 2B), terwijl voor Bonaire de hoogste prevalentie (50%) in oktober 2016 was (Figuur 2D; Tabel 3). Over het algemeen kregen meer vrouwen dan mannen de diagnose (~73%) op zowel Curaçao als Bonaire (Tabel 4), met incidentiecijfers van respectievelijk 737 en 875 per 100.000. Verder werd ZIKV vooral gediagnosticeerd bij mensen tussen de 25-54 jaar oud op zowel Curaçao (61%; incidentie van 863 per 100.000) als Bonaire (67%; incidentie van 815 per 100.000) (Tabel 4).
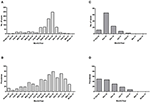 Figuur 2. Absolute aantal gevallen en prevalentie van ZIKV-positieve patiënten bevestigd met qRT-PCR op Curaçao van half december 2015 tot eind april 2017 (A,B), en op Bonaire van half oktober 2016 tot eind april 2017 (C,D).
Figuur 2. Absolute aantal gevallen en prevalentie van ZIKV-positieve patiënten bevestigd met qRT-PCR op Curaçao van half december 2015 tot eind april 2017 (A,B), en op Bonaire van half oktober 2016 tot eind april 2017 (C,D).
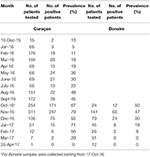 Tabel 3. Prevalentie per maand van qRT-PCR-bevestigde ZIKV-positieve patiënten op Curaçao en Bonaire tijdens de uitbraak.
Tabel 3. Prevalentie per maand van qRT-PCR-bevestigde ZIKV-positieve patiënten op Curaçao en Bonaire tijdens de uitbraak.
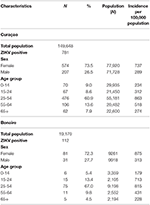 Tabel 4. Kenmerken van de 781 patiënten bevestigd met qRT-PCR voor ZIKV-infectie op Curaçao tussen 16 december 2015 en 26 april 2017, en van de 112 patiënten bevestigd op Bonaire tussen 17 oktober 2016 en 26 april 2017, volgens geslacht en leeftijd [met gebruik van bevolkingsdemografische gegevens van juli 2017 (www.indexmundi.com)].
Tabel 4. Kenmerken van de 781 patiënten bevestigd met qRT-PCR voor ZIKV-infectie op Curaçao tussen 16 december 2015 en 26 april 2017, en van de 112 patiënten bevestigd op Bonaire tussen 17 oktober 2016 en 26 april 2017, volgens geslacht en leeftijd [met gebruik van bevolkingsdemografische gegevens van juli 2017 (www.indexmundi.com)].
Om te zien hoe ZIKV-infecties op Curaçao verspreid waren, hebben we de locaties van patiënten die positief testten voor ZIKV via qRT-PCR op een kaart van Curaçao geplot. We konden 197 patiënten niet precies op de kaart aangeven. De kaart laat zien dat de meeste ZIKV-gevallen in het oostelijke deel van het eiland zaten, vooral in Willemstad (Figuur 3). Geozones met opvallend veel infecties waren Santa Rosa, Spaanse Water, St. Michiel, Dominguito, Brievengat, Berg Altena, Tera Cora, Stenen Koraal en Groot Piscadera.
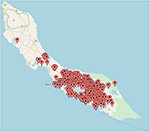 Figuur 3. De locaties van een selectie patiënten op Curaçao die positief testten voor ZIKV via qRT-PCR. De kaart is gemaakt door de locaties te plotten op www.mapcustomizer.com.
Figuur 3. De locaties van een selectie patiënten op Curaçao die positief testten voor ZIKV via qRT-PCR. De kaart is gemaakt door de locaties te plotten op www.mapcustomizer.com.
Discussie
Hoewel ZIKV officieel in mei 2015 in Brazilië opdook in Amerika, schatten fylogenetische analyses dat het virus er eerder was, ergens tussen augustus 2013 en juli 2014 (38) of tussen mei en december 2013 (39). Op Curaçao werden volgens onze analyses de eerste ZIKV-gevallen in december 2015 gediagnosticeerd, een maand voor de eerste melding aan de WHO op 28 januari 2016 (24). Dit geeft aan dat het virus, waarschijnlijk meegebracht door reizigers, er eerder was dan officieel gemeld. Door de snelle verspreiding van het virus in Amerika na de uitbraak in Brazilië waren Curaçao en Bonaire niet voorbereid op een ZIKV-uitbraak. MLS had daarom nog geen diagnostische tests geïmplementeerd en gevalideerd. Dit probleem werd opgelost door patiëntmonsters naar het diagnostisch lab van het EMC in Nederland te sturen, een WHO Collaborating Centre voor arbovirussen. Vanaf oktober 2016 had MLS Curaçao de nodige commerciële diagnostische qRT-PCR-test en ELISA’s geïmplementeerd om door te gaan met de diagnose van ZIKV-verdachte patiënten op Curaçao en te beginnen met de diagnostiek voor Bonaire. Let wel, deze studie was niet vooraf opgezet maar uitgevoerd als reactie op een dynamische uitbraaksituatie.
In deze periode werd voor monsters van Curaçao ook overgestapt van urine naar serum. Hoewel enkele studies hebben aangetoond dat urine gevoeliger was voor ZIKV-detectie via qRT-PCR vergeleken met serum (30, 31), suggereren de gegevens van de gepaarde serum- en urinemonsters van Bonaire dat in deze groep beide matrices tegelijk nodig waren om de kans op ZIKV-detectie te vergroten. Hierdoor is het mogelijk dat veel ZIKV-gevallen op zowel Curaçao als Bonaire zijn gemist, omdat hier niet consequent gepaarde urine- en serummonsters werden verzameld en/of getest met qRT-PCR. Hoewel veel PCR-negatieve monsters van Curaçao en Bonaire ook waren getest met IgM/IgG ELISA, maakt de bekende kruisreactiviteit tussen ZIKV- en DENV-antilichamen diagnose op basis van serologie lastig (36, 37) en kan dit gemakkelijk leiden tot vals-positieven. Daarom hebben we serologiegegevens van monsters van patiënten verzameld 14 dagen na het begin van de symptomen niet meegenomen in onze analyses. Onze resultaten zijn dus waarschijnlijk een onderschatting van het aantal ZIKV-gevallen op beide eilanden. Een andere factor die kan hebben geleid tot een onderschatting van het totale aantal gevallen is het feit dat niet iedereen met symptomen naar de huisarts ging om zich te laten testen. Bovendien waren op Curaçao drie laboratoria betrokken bij de diagnostische tests van ZIKV-patiënten, namelijk MLS, Analytisch Diagnostisch Centrum (ADC) en Laboratorio de Medicos (LabdeMed). Als alle gegevens zouden worden gecombineerd, zou het totale aantal ZIKV-gevallen waarschijnlijk veel groter zijn dan in dit artikel wordt gepresenteerd.
De piek van de ZIKV-uitbraak op Curaçao leek in november 2016 te zijn, zowel qua absoluut aantal gevallen als prevalentie. Voor Bonaire leek de piek in het absolute aantal gevallen ook in november 2016 te zijn, terwijl de prevalentie in oktober 2016 het hoogst leek. Maar omdat er tussen half december 2015 en half oktober 2016 geen ZIKV-diagnostiek voor Bonaire werd uitgevoerd, zijn de gegevens van oktober niet betrouwbaar om te vergelijken met de andere maanden. Het kan ook niet worden uitgesloten dat een groter aantal mensen op Bonaire in een van de maanden vóór november geïnfecteerd kan zijn geweest.
Grappig genoeg werden er tijdens de gerapporteerde uitbraak van ZIKV op Curaçao en Bonaire geen gevallen van microcefalie of sterfgevallen door ZIKV gemeld. Maar als je uitgaat van hetzelfde microcefalie-risico van 0,02% voor zwangere vrouwen zoals berekend voor Brazilië (40), en een vruchtbaarheidscijfer van ~2,1 voor Curaçao [gebaseerd op data uit 2011 (41)], wat neerkomt op ~2.100 levendgeborenen per jaar, zou dit 0,42 gevallen van microcefalie hebben opgeleverd tijdens de uitbraak op Curaçao (die ongeveer een jaar duurde). Het is dus niet verrassend dat er geen gevallen van ZIKV-gerelateerde microcefalie werden waargenomen in een bevolking van slechts 150.000 en 19.000 mensen.
Tijdens de uitbraak van ZIKV op zowel Curaçao als Bonaire raakten bijna drie keer zoveel vrouwen als mannen besmet met het virus. Besmettingen kwamen vooral voor in de leeftijdscategorie van 25-54 jaar voor zowel mannen als vrouwen. Dit hogere aandeel vrouwelijke besmettingen tijdens een ZIKV-uitbraak werd ook gemeld in Suriname (42) en Rio de Janeiro in Brazilië (43). Dit onevenredige besmettingspercentage kan worden verklaard door het verhoogde testen van zwangere vrouwen vanwege de zorgen over microcefalie en andere risico’s voor ongeboren baby’s. Maar zo’n trend werd ook aangetoond in Rio de Janeiro tijdens een DENV-uitbraak (43), waar vrouwen 30% meer kans hadden om gediagnosticeerd te worden met DENV dan mannen. Een verklaring die in deze studie werd gesuggereerd, was dat vrouwen meer gewetensvoller zijn over hun gezondheid en daarom eerder naar een huisarts gaan. Toch is er een andere mogelijkheid, zoals ook gespeculeerd in de Coelho-studie (43), namelijk dat er voor ZIKV een hogere hoeveelheid man-naar-vrouw seksuele overdrachten plaatsvindt in vergelijking met vrouw-naar-man overdrachten. Besmetting van vrouwen door ZIKV via sperma is al aangetoond (1–3), en hoewel ZIKV ook is gedetecteerd in het vrouwelijke genitale stelsel en vaginale afscheiding (44–47), is het vermogen van het virus om mannen productief te infecteren via vaginale afscheiding tijdens geslachtsgemeenschap nog niet aangetoond. Bovendien moet de invloed van vrouwelijke voortplantingshormonen op ZIKV-replicatie en -overdracht ook worden onderzocht, aangezien onlangs is aangetoond dat progestagenen de infectie van hiv in het vrouwelijke voortplantingsstelsel van niet-menselijke primaten bevorderen (48).
Om een indruk te krijgen van de verspreiding van het aantal ZIKV-gevallen op Curaçao, werden de locaties van de patiënten op een kaart uitgezet. De meerderheid van de gevallen bevond zich in het oosten van het eiland, wat het gevolg kan zijn van een rapportage-bias veroorzaakt door een hogere bevolkingsdichtheid in het oosten (Willemstad) (41). Desalniettemin werd voor geozones met het grootste aantal ZIKV-gevallen geen bepaalde trend in termen van bevolkingsdichtheid of gemiddeld bruto maandinkomen per huishouden geïdentificeerd (gegevens niet getoond). Het is mogelijk dat de ruimtelijke verdeling van ZIKV-gevallen een weerspiegeling is van de aanwezigheid van met ZIKV besmette muggen; echter, aangezien veel inwoners van Curaçao dagelijks naar verschillende delen van het eiland reizen, is het niet mogelijk om met zekerheid de locatie van overdracht te bepalen. Naast muggenoverdracht kan ook seksuele overdracht van ZIKV de ruimtelijke verdeling van gevallen op het eiland hebben beïnvloed.
Conclusies
Aangezien Curaçao en Bonaire (potentiële) hotspots zijn voor opkomende en terugkerende arbovirusinfecties, is het belangrijk dat de eilanden voorbereid zijn op toekomstige uitbraken door van tevoren de juiste diagnostische tools te implementeren. Maar naast effectieve diagnostiek is het ook noodzakelijk dat de juiste infrastructuur wordt opgezet om communicatie tijdens een uitbraaksituatie mogelijk te maken en de implementatie van risicoverlagende activiteiten te vergemakkelijken om met elke infectieziekte om te gaan die in de toekomst kan opduiken.
Verklaring over Beschikbaarheid van Gegevens
De datasets die tijdens de huidige studie zijn gegenereerd en/of geanalyseerd, zijn niet openbaar beschikbaar vanwege de privacyrechten van patiënten, maar een selectie van datasets is op redelijk verzoek verkrijgbaar bij de corresponderende auteur.
Ethische Verklaring
Schriftelijke toestemming werd verkregen van elke persoon die urine-, serum- of plasmamonsters verstrekte. Toestemming voor kinderen onder de 16 jaar werd gegeven door hun ouder of voogd. Aangezien MLS en de afdeling Virologie gemandateerd zijn om laboratoriumondersteuning te bieden voor uitbraakonderzoeken, werd geen aanvullende ethische goedkeuring gezocht.
Bijdragen van Auteurs
RW, SP en GB coördineerden en superviseerden de laboratoriumdiagnostiek en logistiek. SL, SP en GB waren betrokken bij de analyses. SL, SP, MK en BM schreven het manuscript.
Financiering
Yo, het onderzoek dat deze resultaten opleverde heeft poen gekregen van COMPARE (Europese Unie’s Horizon 2020, Subsidieovereenkomst Nr. 643476), ZikaRisk (NWO ZonMW Project Nr. 522003001), en ZIKAlliance (Europese Unie’s Horizon 2020, Subsidieovereenkomst Nr. 734548). De geldschieters hadden niks te zeggen over het onderzoeksontwerp, dataverzameling en analyse, besluit om te publiceren, of het voorbereiden van het manuscript.
Belangenconflict
De auteurs verklaren dat het onderzoek is uitgevoerd zonder enige commerciële of financiële relaties die gezien zouden kunnen worden als een potentieel belangenconflict.
Dankwoord
We willen alle laboranten en medewerkers van MLS en de afdeling Virologie bedanken voor hun technische en organisatorische bijdragen.
Afkortingen
ZIKV, Zikavirus; DENV, denguevirus; CHIKV, chikungunyavirus; IgM, immunoglobuline M; IgG, immunoglobuline G; ELISA, enzyme-linked immunosorbent assay; qRT-PCR, kwantitatieve real-time polymerase kettingreactie; RNA, ribonucleïnezuur; EDTA, ethyleendiaminetetra-azijnzuur; WHO, Wereldgezondheidsorganisatie; NAT, nucleïnezuurtesten; MLS, Medical Laboratory Services; EMC, Erasmus Medisch Centrum; NS2A, niet-structureel eiwit 2A; PDV, hondenziektevirus; CT, cyclusdrempel; FTD, Fast Track Diagnostics; ADC, Analytisch Diagnostisch Centrum; HIV, humaan immunodeficiëntievirus.
Referenties
1. Foy BD, Kobylinski KC, Chilson Foy JL, Blitvich BJ, Travassos da Rosa A, Haddow AD, et al. Waarschijnlijke niet-vectorgebonden overdracht van Zikavirus, Colorado, VS. Emerg Infect Dis. (2011) 17:880–2. doi: 10.3201/eid1705.101939
2. Hills SL, Russell K, Hennessey M, Williams C, Oster AM, Fischer M, et al. Overdracht van Zikavirus door seksueel contact met reizigers naar gebieden met aanhoudende transmissie – continentale Verenigde Staten, 2016. MMWR Morb Mortal Wkly Rep. (2016) 65:215–6. doi: 10.15585/mmwr.mm6508e2
3. D’Ortenzio E, Matheron S, Yazdanpanah Y, de Lamballerie X, Hubert B, Piorkowski G, et al. Bewijs van seksuele overdracht van Zikavirus. N Engl J Med. (2016) 374:2195–8. doi: 10.1056/NEJMc1604449
4. Calvet G, Aguiar RS, Melo ASO, Sampaio SA, de Filippis I, Fabri A, et al. Detectie en sequencing van Zikavirus uit vruchtwater van foetussen met microcefalie in Brazilië: een casestudy. Lancet Infect Dis. (2016) 16:653–60. doi: 10.1016/S1473-3099(16)00095-5
5. Galán-Huerta KA, Rivas-Estillaa AM, Martinez-Landerosb EA, Arellanos-Sotoab D, Ramos-Jiménez J. De Zikavirusziekte: een overzicht. Med Univ. (2016) 18:115–24. doi: 10.1016/j.rmu.2016.05.003
7. Cao-Lormeau VM, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, et al. Uitbraak van Guillain-Barré-syndroom geassocieerd met Zikavirusinfectie in Frans-Polynesië: een case-controlstudie. Lancet. (2016) 387:1531–9. doi: 10.1016/S0140-6736(16)00562-6
8. Roze B, Najioullah F, Fergé JL, Dorléans F, Apetse K, Barnay JL, et al. Guillain-Barré-syndroom geassocieerd met Zikavirusinfectie in Martinique in 2016: een prospectieve studie. Clin Infect Dis. (2017) 65:1462–8. doi: 10.1093/cid/cix588
10. Araujo LM, Ferreira ML, Nascimento OJ. Guillain-Barre syndroom geassocieerd met de Zika-virusuitbraak in Brazilië. Arq Neuropsiquiatr. (2016) 74:253–5. doi: 10.1590/0004-282X20160035
11. Yepez JB, Murati FA, Pettito M, Peñaranda CF, de Yepez J, Maestre G, et al. Oogheelkundige manifestaties van congenitaal Zika-syndroom in Colombia en Venezuela. JAMA Ophthalmol. (2017) 135:440–5. doi: 10.1001/jamaophthalmol.2017.0561
12. Kodati S, Palmore TN, Spellman FA, Cunningham D, Weistrop B, Sen HN. Bilaterale posterieure uveïtis geassocieerd met Zika-virusinfectie. Lancet. (2017) 389:125–6. doi: 10.1016/S0140-6736(16)32518-1
13. Wong CW, Ng SR, Cheung CMG, Wong TY, Mathur R. Zika-gerelateerde maculopathie. Retin Cases Brief Rep. (2019) 13:171–3. doi: 10.1097/ICB.0000000000000552
14. Miranda-Filho DDB, Martelli CM, Ximenes RA, Araújo TV, Rocha MA, Ramos RC, et al. Eerste beschrijving van het vermoedelijke congenitale Zika-syndroom. Am J Public Health. (2016) 106:598–600. doi: 10.2105/AJPH.2016.303115
15. de Araujo TVB, Rodrigues LC, de Alencar Ximenes RA, de Barros Miranda-Filho D, Montarroyos UR, de Melo APL, et al. Verband tussen Zika-virusinfectie en microcefalie in Brazilië, januari tot mei 2016: voorlopig rapport van een case-control onderzoek. Lancet Infect Dis. (2016) 16:1356–63. doi: 10.1016/S1473-3099(16)30318-8
16. Rubin EJ, Greene MF, Baden LR. Zika-virus en microcefalie. N Engl J Med. (2016) 374:984–5. doi: 10.1056/NEJMe1601862
17. Honein MA, Dawson AL, Petersen EE, Jones AM, Lee EH, Yazdy MM, et al. Geboorteafwijkingen bij foetussen en zuigelingen van Amerikaanse vrouwen met aanwijzingen voor mogelijke Zika-virusinfectie tijdens de zwangerschap. JAMA. (2017) 317:59–68. doi: 10.1001/jama.2016.19006
18. Brasil P, Pereira JP Jr, Moreira ME, Ribeiro Nogueira RM, Damasceno L, Wakimoto M, et al. Zika-virusinfectie bij zwangere vrouwen in Rio de Janeiro. N Engl J Med. (2016) 375:2321–34. doi: 10.1056/NEJMoa1602412
19. Duffy MR, Chen TH, Hancock WT, Powers AM, Kool JL, Lanciotti RS, et al. Zika-virusuitbraak op Yap Island, Federale Staten van Micronesië. N Engl J Med. (2009) 360:2536–43. doi: 10.1056/NEJMoa0805715
20. Roth A, Mercier A, Lepers C, Hoy D, Duituturaga S, Benyon E, et al. Gelijktijdige uitbraken van dengue-, chikungunya- en Zika-virusinfecties – een ongekende epidemische golf van door muggen overgedragen virussen in de Stille Oceaan 2012-2014. Euro Surveill. (2014) 19:20929. doi: 10.2807/1560-7917.ES2014.19.41.20929
21. Tognarelli J, Ulloa S, Villagra E, Lagos J, Aguayo C, Fasce R, et al. Een rapport over de uitbraak van het Zika-virus op Paaseiland, Zuid-Stille Oceaan, 2014. Arch Virol. (2016) 161:665–8. doi: 10.1007/s00705-015-2695-5
22. Dupont-Rouzeyrol M, O’Connor O, Calvez E, Daurès M, John M, Grangeon JP, et al. Co-infectie met Zika- en denguevirussen bij 2 patiënten, Nieuw-Caledonië, 2014. Emerg Infect Dis. (2015) 21:381–2. doi: 10.3201/eid2102.141553
23. Fauci AS, Morens DM. Zikavirus in Amerika – nog een arbovirusdreiging. N Engl J Med. (2016) 374:601–4. doi: 10.1056/NEJMp1600297
24. Kindhauser MK, Allen T, Frank V, Santhana RS, Dye C. Zika: de oorsprong en verspreiding van een door muggen overgedragen virus. Bull World Health Organ. (2016) 94:675–86C. doi: 10.2471/BLT.16.171082
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
25. Pan-Amerikaanse Gezondheidsorganisatie/Wereldgezondheidsorganisatie. Tijdlijn van de opkomst van het zikavirus in Amerika. Washington, DC: Pan-Amerikaanse Gezondheidsorganisatie/Wereldgezondheidsorganisatie (2016).
26. Ministério da Saúde. Protocol voor toezicht en reactie op het optreden van microcefalie gerelateerd aan zikavirus-infectie. Brasília: Afdeling Toezicht op Overdraagbare Ziekten, Communicatiekern/SVS (2015).
27. Pan-Amerikaanse Gezondheidsorganisatie/Wereldgezondheidsorganisatie. PLISA: Gezondheidsinformatieplatform voor de Amerika’s – Gerapporteerde gevallen van Dengue-koorts in Amerika. Pan-Amerikaanse Gezondheidsorganisatie/Wereldgezondheidsorganisatie. Beschikbaar op: http://www.paho.org/data/index.php/en/mnu-topics/indicadores-dengue-en/dengue-nacional-en/252-dengue-pais-ano-en.html (geraadpleegd op 19 juli 2018).
28. Pan-Amerikaanse Gezondheidsorganisatie/Wereldgezondheidsorganisatie. Aantal gerapporteerde gevallen van Chikungunya-koorts in Amerika, per land of gebied 2013-2014, Cumulatieve gevallen, EW 49. (2014). Beschikbaar op: https://www.paho.org/hq/dmdocuments/2014/2014-dec-05-cha-chikungunya-cases-ew-49.pdf (geraadpleegd op 14 november 2018).
29. Lanciotti RS, Kosoy OL, Laven JJ, Velez JO, Lambert AJ, Johnson AJ, et al. Genetische en serologische eigenschappen van zikavirus geassocieerd met een epidemie, Yap State, Micronesië, 2007. Emerg Infect Dis. (2008) 14:1232–9. doi: 10.3201/eid1408.080287
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
30. Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Detectie van zikavirus in urine. Emerg Infect Dis. (2015) 21:84–6. doi: 10.3201/eid2101.140894
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
31. Lamb LE, Bartolone SN, Kutluay SB, Robledo D, Porras A, Plata M, et al. Voordeel van urine-gebaseerde moleculaire diagnose van zikavirus. Int Urol Nephrol. (2016) 48:1961–6. doi: 10.1007/s11255-016-1406-9
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
32. Lustig Y, Mendelson E, Paran N, Melamed S, Schwartz E. Detectie van zikavirus-RNA in volbloed van geïmporteerde zikavirus-ziektecases tot 2 maanden na symptoombegin, Israël, december 2015 tot april 2016. Euro Surveill. (2016) 21:30269. doi: 10.2807/1560-7917.ES.2016.21.26.30269
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
33. Wereldgezondheidsorganisatie. Laboratoriumtesten voor zikavirus-infectie, WHO/ZIKV/LAB/16.1 (2016).
34. Ferreira-de-Brito A, Ribeiro IP, Miranda RM, Fernandes RS, Campos SS, Silva KA, et al. Eerste detectie van natuurlijke infectie van Aedes aegypti met zikavirus in Brazilië en in heel Zuid-Amerika. Mem Inst Oswaldo Cruz. (2016) 111:655–8. doi: 10.1590/0074-02760160332
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
35. Hoek RA, Paats MS, Pas SD, Bakker M, Hoogsteden HC, Boucher CA, et al. Incidentie van virale respiratoire pathogenen die exacerbaties veroorzaken bij volwassen patiënten met cystische fibrose. Scand J Infect Dis. (2013) 45:65–9. doi: 10.3109/00365548.2012.708942
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
36. Priyamvada L, Quicke KM, Hudson WH, Onlamoon N, Sewatanon J, Edupuganti S, et al. Menselijke antilichaamreacties na dengue-virusinfectie zijn zeer kruisreactief met zikavirus. Proc Natl Acad Sci USA. (2016) 113:7852–7. doi: 10.1073/pnas.1607931113
PubMed Samenvatting | CrossRef Volledige Tekst | Google Scholar
37. Felix AC, Souza NCS, Figueiredo WM, Costa AA, Inenami M, da Silva RMG, et al. Kruisreactiviteit van commerciele anti-dengue immunoassays bij patiënten met acute Zika-virusinfectie. J Med Virol. (2017) 89:1477–9. doi: 10.1002/jmv.24789
38. Metsky HC, Matranga CB, Wohl S, Schaffner SF, Freije CA, Winnicki SM, et al. Zika-virusevolutie en -verspreiding in Amerika. Nature. (2017) 546:411–5. doi: 10.1038/nature22402
39. Faria NR, Azevedo RDSDS, Kraemer MUG, Souza R, Cunha MS, Hill SC, et al. Zika-virus in Amerika: vroege epidemiologische en genetische bevindingen. Science. (2016) 352:345–9. doi: 10.1126/science.aaf5036
40. Jaenisch T, Rosenberger KD, Brito C, Brady O, Brasil P, Marques ETA. Risico op microcefalie na Zika-virusinfectie in Brazilië, 2015 tot 2016. Bull World Health Organ. (2017) 95:191–8. doi: 10.2471/BLT.16.178608
42. Codrington J, Roosblad J, Baidjoe A, Holband N, Adde A, Kazanji M, et al. Zika-virusuitbraak in Suriname, een rapport gebaseerd op laboratoriumsurveillancegegevens. PLoS Curr. (2018) 10. doi: 10.1371/currents.outbreaks.ff0f6190d5431c2a2e824255eaeaf339
43. Coelho FC, Durovni B, Saraceni V, Lemos C, Codeco CT, Camargo S, et al. Hogere incidentie van Zika bij volwassen vrouwen dan bij volwassen mannen in Rio de Janeiro suggereert een significante bijdrage van seksuele overdracht van mannen naar vrouwen. Int J Infect Dis. (2016) 51:128–32. doi: 10.1016/j.ijid.2016.08.023
44. Penot P, Brichler S, Guilleminot J, Lascoux-Combe C, Taulera O, Gordien E, et al. Infectieus Zika-virus in vaginale afscheiding van een hiv-geïnfecteerde vrouw, Frankrijk, augustus 2016. Euro Surveill. (2017) 22:30444. doi: 10.2807/1560-7917.ES.2017.22.3.30444
46. Tang WW, Young MP, Mamidi A, Regla-Nava JA, Kim K, Shresta S. Een muismodel van seksuele overdracht van het Zika-virus en vaginale virusreplicatie. Cell Rep. (2016) 17:3091–8. doi: 10.1016/j.celrep.2016.11.070
47. Sanchez-Montalva A, Pou D, Sulleiro E, Salvador F, Bocanegra C, Treviño B, et al. Zika-virusdynamiek in lichaamsvloeistoffen en risico op seksuele overdracht in een niet-endemisch gebied. Trop Med Int Health. (2018) 23:92–100. doi: 10.1111/tmi.13019
48. Carias AM, Allen SA, Fought AJ, Kotnik Halavaty K, Anderson MR, Jimenez ML, et al. Toenames in endogene of exogene progestinen bevorderen virus-doelcelinteracties binnen het vrouwelijke voortplantingsstelsel van niet-menselijke primaten. PLoS Pathog. (2016) 12:e1005885. doi: 10.1371/journal.ppat.1005885
Trefwoorden: Zika-virus, uitbraak, laboratorium, qRT-PCR, epidemiologie, Curaçao, Bonaire
Citatie: Lim SM, Wever R, Pas SD, Bonofacio G, Koopmans MPG en Martina BEE (2019) Zika-virusuitbraak op Curaçao en Bonaire, een rapport gebaseerd op laboratoriumdiagnostiekgegevens. Front. Public Health 7:333. doi: 10.3389/fpubh.2019.00333
Ontvangen: 11 juni 2019; Geaccepteerd: 25 oktober 2019;
Bewerkt door:
Beoordeeld door:
Man-Qing Liu, Centrum voor Ziektepreventie en -bestrijding in Wuhan, China
José Eduardo Levi, Universiteit van São Paulo, Brazilië
Copyright © 2019 Lim, Wever, Pas, Bonofacio, Koopmans en Martina. Dit is een open access artikel verspreid onder de voorwaarden van de Creative Commons Attribution License (CC BY). Het gebruik, de verspreiding of reproductie in andere forums is toegestaan, mits de oorspronkelijke auteur(s) en de copyrighthouder(s) worden vermeld en de oorspronkelijke publicatie in dit tijdschrift wordt geciteerd, in overeenstemming met geaccepteerde academische praktijken. Gebruik, verspreiding of reproductie die niet aan deze voorwaarden voldoet, is niet toegestaan.
*Correspondentie: Stephanie M. Lim, [email protected]