Stephanie M. Lim1*,
Stephanie M. Lim1*,  Robert Wever2,
Robert Wever2,  Suzan D. Pas3,
Suzan D. Pas3,  Gygliola Bonofacio2,
Gygliola Bonofacio2,  Marion P. G. Koopmans3 et
Marion P. G. Koopmans3 et  Byron E. E. Martina1,3
Byron E. E. Martina1,3- 1Fondation de recherche Artemis One Health, Delft, Pays-Bas
- 2Services de laboratoire médical, Willemstad, Curaçao
- 3Département de Virologie, Centre collaborateur de l’OMS pour les arbovirus et les fièvres hémorragiques, Centre médical Erasmus, Rotterdam, Pays-Bas
Contexte : Le virus Zika (ZIKV) est apparu en mai 2015 au Brésil, d’où il s’est propagé à de nombreux autres pays d’Amérique latine. Des cas d’infection par le ZIKV ont finalement été également signalés à Curaçao (janvier 2016) et à Bonaire (février 2016).
Méthodes : Durant la période du 16 décembre 2015 au 26 avril 2017, des échantillons de sérum, de plasma EDTA ou d’urine ont été prélevés aux Services de laboratoire médical (MLS) sur des patients à Curaçao et testés par qRT-PCR au Centre médical Erasmus (EMC) aux Pays-Bas. Entre le 17 octobre 2016 et le 26 avril 2017, tous les échantillons de patients suspectés d’être atteints du ZIKV recueillis à Curaçao, ainsi qu’à Bonaire, ont été testés au MLS. Des échantillons appariés d’urine et/ou de sérum provenant de patients ont été analysés pour la cinétique d’excrétion du ZIKV, et comparés en termes de sensibilité pour la détection de l’ARN du ZIKV. De plus, l’âge et le sexe des patients ont été utilisés pour déterminer les taux d’incidence du ZIKV, et leur localisation géographique pour déterminer la distribution spatiale des cas de ZIKV.
Résultats : Au total, 781 patients sur 2820 individus testés se sont révélés positifs au ZIKV par qRT-PCR à Curaçao. Les deux premiers cas de ZIKV ont été diagnostiqués en décembre 2015. Un total de 112 patients sur 382 individus testés se sont révélés positifs au ZIKV par qRT-PCR à Bonaire. Pour les deux îles, le pic du nombre absolu de cas s’est produit en novembre 2016, avec 247 cas confirmés par qRT-PCR à Curaçao et 66 cas positifs par qRT-PCR à Bonaire. Dans l’ensemble, une proportion plus élevée de femmes que d’hommes a été diagnostiquée avec le ZIKV sur les deux îles, ainsi que principalement des individus dans la catégorie d’âge de 25 à 54 ans. En outre, les cas de ZIKV étaient principalement regroupés dans l’est de l’île, à Willemstad.
Conclusions : Les cas de ZIKV confirmés par qRT-PCR indiquent que le virus circulait à Curaçao entre au moins décembre 2015 et mars 2017, et à Bonaire entre au moins octobre 2016 et février 2017, avec un pic de cas survenant en novembre 2016. Le manque de préparation de Curaçao pour l’épidémie de ZIKV a été compensé par l’envoi de tous les échantillons à l’EMC pour des tests diagnostiques ; cependant, les deux îles devront mettre en place l’infrastructure appropriée pour permettre une réponse rapide à une épidémie de tout nouveau virus émergent à l’avenir.
Introduction
Le virus Zika (ZIKV) est un arbovirus qui appartient à la famille des Flaviviridae, genre Flavivirus, et est transmis par la piqûre de moustiques Aedes aegypti infectés, par contact sexuel (1–3), ou de la mère au fœtus (4). L’infection par le ZIKV est souvent asymptomatique ou se présente autrement avec des symptômes légers tels que fièvre, éruption maculopapuleuse, conjonctivite, myalgie et céphalées (5). Dans un petit nombre de cas, l’infection par le ZIKV peut entraîner de graves complications telles que le syndrome de Guillain-Barré (6–10), la maculopathie (11–13), ou la microcéphalie chez les nouveau-nés lorsque la mère est infectée par le virus pendant la grossesse (14–18).
Historiquement, depuis sa découverte en Ouganda en 1947, le ZIKV était confiné à l’Afrique, ne provoquant que des cas sporadiques de maladie bénigne. En 2007, cependant, ce schéma a changé lorsque la première épidémie majeure de ZIKV s’est produite à Yap (États fédérés de Micronésie) où environ 73 % de la population a été infectée et une maladie symptomatique s’est développée chez environ 18 % des personnes infectées (19). Depuis lors, le ZIKV s’est rapidement propagé à travers l’océan Pacifique, provoquant des épidémies en Polynésie française (20), aux îles Cook (20), à l’île de Pâques (21), en Nouvelle-Calédonie (22), jusqu’à finalement émerger dans les Amériques (23). Il a d’abord été signalé au Brésil en Amérique du Sud continentale en mai 2015, après quoi le virus s’est propagé à d’autres pays d’Amérique latine, tels que la Colombie (octobre 2015), le Suriname, El Salvador, le Mexique, le Guatemala, le Paraguay, le Venezuela (novembre 2015), le Panama, le Honduras, la Guyane française, la Martinique, Porto Rico (décembre 2015), les Maldives, la Guyane, l’Équateur, la Barbade, la Bolivie, Haïti, Saint-Martin, la République dominicaine, le Nicaragua, la Jamaïque, Curaçao, le Costa Rica (janvier 2016), Bonaire et Aruba (février 2016) (24, 25). Au Brésil seulement, on estime qu’entre 440 000 et 1,3 million de personnes ont été infectées par le ZIKV en 2015 (26), et environ 2366 cas de microcéphalie/malformations du SNC associés au ZIKV ont été signalés (en février 2017, www.statista.com). Depuis lors, l’épidémie a continué de se propager, et le nombre total de personnes infectées et d’enfants atteints du syndrome congénital du ZIKV reste encore à déterminer.
Curaçao, une nation d’environ 150 000 habitants, est connue pour la circulation de virus transmis par A. aegypti, tels que le virus de la dengue (DENV) et le virus chikungunya (CHIKV). Le DENV est endémique à Curaçao depuis des décennies et des épidémies du virus s’y produisent tous les quelques années. L’épidémie de dengue la plus récente s’est produite en 2014, où les autorités sanitaires de Curaçao avaient signalé 194 cas suspects et 20 cas confirmés de dengue à la fin du mois d’août (27). En juin de la même année, le premier cas de CHIKV a également été signalé, ce qui a marqué le début d’une épidémie majeure sur l’île qui a duré jusqu’en février 2015. À la fin du mois de novembre 2014, 1 838 cas suspects et 835 cas confirmés de CHIKV avaient été signalés (28). La dengue est également endémique à Bonaire, une nation d’environ 19 000 habitants, mais peu de rapports sont disponibles.
En raison du haut degré de réactivité croisée sérologique entre les flavivirus, la confirmation de l’infection pose un défi. Comme l’on pense que les IgM sont plus spécifiques que les IgG, la détection des IgM contre le ZIKV par ELISA représente une possibilité ; cependant, une réactivité croisée des IgM du DENV et du ZIKV a été démontrée (29). Cela signifie que des tests de neutralisation confirmatifs seraient toujours nécessaires. Par conséquent, la confirmation des infections par les flavivirus est principalement basée sur la détection de l’ARN viral dans le sérum en utilisant la PCR quantitative en temps réel (qRT-PCR). Cependant, pour plusieurs arbovirus tels que le DENV ou le ZIKV, le niveau de virémie présent dans le sang pendant la phase symptomatique est souvent très faible, ce qui rend la détection problématique. L’utilisation de l’urine comme matrice alternative pour détecter l’ARN du ZIKV a été étudiée par plusieurs laboratoires et s’est avérée être une bonne alternative au sérum, au plasma EDTA et à la salive, en raison des niveaux plus élevés d’ARN trouvés et de la période plus longue pendant laquelle l’urine a été trouvée positive après l’apparition des symptômes (>10-20 jours) (30, 31). En revanche, une autre étude a démontré la détection du ZIKV dans le sang total pendant une période plus longue par rapport à l’urine et au sérum (32). Sur la base de ces observations, les recommandations intérimaires officielles de l’Organisation mondiale de la Santé (OMS) incluaient l’utilisation soit de sang total, de sérum ou d’urine pour les tests d’acide nucléique (TAN), et de sérum pour la détection des IgM (33). La confirmation systématique des résultats sérologiques par des tests de neutralisation du virus n’était pas recommandée car elle était considérée comme irréalisable.
Pour définir l’étendue de l’épidémie de ZIKV à Curaçao et à Bonaire, nous avons déterminé le nombre de cas confirmés de ZIKV sur la base de diagnostics par qRT-PCR, les taux d’incidence de l’infection chez les patients en termes d’âge et de sexe, ainsi que la distribution géospatiale des cas de ZIKV à Curaçao. De plus, des échantillons d’urine appariés de Curaçao ont été évalués pour la cinétique d’excrétion du ZIKV, tandis que des échantillons appariés d’urine et de sérum de Bonaire ont été comparés pour la sensibilité de la détection de l’ARN du ZIKV.
Méthodes
Durant la période du 16 décembre 2015 au 26 avril 2017, des échantillons de sérum, de plasma EDTA ou d’urine ont été prélevés aux Services de laboratoire médical (MLS) auprès de patients à Curaçao présentant des symptômes ressemblant à l’infection par le ZIKV, tels que fièvre, éruption cutanée, maux de tête ou conjonctivite. Entre le 16 décembre 2015 et le 15 octobre 2016, les échantillons recueillis ont été inactivés et stabilisés dans un tampon de lyse MagnaPure (Roche Diagnostics, Almere, Pays-Bas) et expédiés au laboratoire de diagnostic du Centre médical Erasmus (EMC) à Rotterdam, Pays-Bas, où l’ARN du ZIKV a été testé par une qRT-PCR semi-quantitative développée en laboratoire, validée ISO15189:2012 et contrôlée en interne. En bref, les acides nucléiques totaux ont été isolés à l’aide d’un protocole de lyse externe sur le système robotique MagNA Pure LC (Roche Diagnostics) puis testés dans deux qRT-PCR indépendantes utilisant le TaqMan® 1-Step Fast-Virus Master Mix (Thermo Fisher Scientific, Bleiswijk, Pays-Bas) et des amorces ciblant l’enveloppe et le NS2A, en multiplex avec un contrôle interne (PDV), dans un cycleur LC480-II (Roche Life Science) (Tableau 1). Le seuil a été fixé à <45 valeurs CT. À partir du 6 juillet 2016, seule la paire d’amorces ciblant l’enveloppe a été utilisée dans la qRT-PCR pour confirmer l’infection par le ZIKV.
 Tableau 1. Amorces et sonde qRT-PCR développées en laboratoire utilisées pour le diagnostic du ZIKV.
Tableau 1. Amorces et sonde qRT-PCR développées en laboratoire utilisées pour le diagnostic du ZIKV.
Comme l’étiologie des manifestations cliniques des patients était encore incertaine au cours des deux premiers mois de l’épidémie (décembre 2015 et janvier 2016), les échantillons de sérum prélevés sur les patients ont également été testés pour l’ARN du DENV et du CHIKV en utilisant le FTD Dengue/Chik multiplex (Fast Track Diagnostics, Esch-sur-Alzette, Luxembourg). Entre décembre 2015 et octobre 2016, des échantillons d’urine appariés (plasma si l’urine n’était pas disponible) avec un intervalle cible d’environ 2 semaines ont été soumis pour analyse. À partir de février 2016, soit des échantillons d’urine (matrice de choix), soit des échantillons de plasma EDTA (si l’urine n’était pas disponible) ont été prélevés chez les patients.
Durant la période du 17 octobre 2016 au 26 avril 2017, après la mise en place de tests diagnostiques commerciaux pour le ZIKV au MLS, tous les échantillons de patients suspectés de ZIKV à Curaçao ont été collectés et testés au MLS. Durant cette période, des échantillons ont également été prélevés chez des patients suspectés de ZIKV à Bonaire par Fundashon Mariadal et envoyés au MLS pour analyse. Contrairement à Curaçao, il a été choisi ici de collecter des échantillons appariés de sérum et d’urine le même jour, chez un grand nombre de patients. Les tests diagnostiques du ZIKV comprenaient la qRT-PCR et/ou l’ELISA IgM/IgG (Euroimmun, Lübeck, Allemagne). Pour la qRT-PCR, les acides nucléiques totaux ont été isolés à l’aide du système robotique MagNA Pure (Roche Diagnostics) et testés dans une qRT-PCR utilisant le FTD Zika virus multiplex (Fast Track Diagnostics). En fonction du nombre de jours après l’apparition des symptômes auxquels le patient a été soumis au test, le choix a été fait soit pour la qRT-PCR seule (0-7 jours), la qRT-PCR et la sérologie (7-14 jours), ou la sérologie seule (≥14 jours). Cependant, comme ni un résultat ELISA positif pour les IgM ou les IgG du ZIKV dans une zone endémique pour le DENV ne peut être considéré comme fiable en raison de la réactivité croisée connue pour exister entre les anticorps du DENV et du ZIKV (36, 37), nous n’avons considéré que les résultats positifs obtenus en qRT-PCR pour les analyses.
Durant la période du 17 octobre 2016 au 8 novembre 2016, des échantillons de plasma ont été testés, mais à partir du 9 novembre 2016, le sérum a été choisi de préférence au plasma EDTA en raison de sa praticité et de sa durabilité supérieures en laboratoire, ainsi que des recommandations faites par l’Organisation mondiale de la Santé (33). L’urine n’était plus la matrice de choix car le sérum pouvait être utilisé à la fois en qRT-PCR et en ELISA.
Curaçao peut être divisé en 65 géozones, qui se composent d’un ou plusieurs quartiers. La géozone de résidence des patients a été utilisée comme indicateur de localisation et reportée sur une carte de Curaçao à l’aide de www.mapcustomizer.com. Les taux d’incidence du ZIKV ont été déterminés pour différentes catégories d’âge et le sexe des patients.
Les informations telles que les symptômes présentés, le jour d’apparition et la grossesse n’ont pas été correctement documentées par les médecins généralistes à Curaçao ou à Bonaire, et par conséquent, ces données n’ont pas pu être incluses dans les analyses. Un consentement écrit a été fourni par chaque individu soumettant un échantillon d’urine, de sérum ou de plasma pour analyse, et un consentement écrit pour les enfants de moins de 16 ans a été fourni par leur parent ou tuteur. Comme les échantillons des patients n’ont été collectés qu’à des fins de diagnostic, aucune autorisation éthique supplémentaire n’a été requise pour cette étude.
Analyses statistiques
Les échantillons appariés ont été analysés à l’aide d’un test t apparié bilatéral et les valeurs P égales ou inférieures à 0,5 ont été considérées comme statistiquement significatives.
Résultats
Entre le 16 décembre 2015 et le 26 avril 2017, 3 833 échantillons provenant de 2 820 individus ont été recueillis par MLS à Curaçao. Parmi ceux-ci, 2 044 échantillons appartenant à 1 685 patients ont été analysés par qRT-PCR, résultant en 815 échantillons positifs à la qRT-PCR, correspondant à 781 patients positifs au ZIKV (Tableau 2). L’analyse des échantillons sériques des patients suspectés de ZIKV à Curaçao a été initiée en décembre 2015, au cours duquel deux patients ont été testés positifs au ZIKV par qRT-PCR. Durant les deux premiers mois de l’épidémie (décembre 2015 et janvier 2016), lorsque les échantillons sériques étaient également testés pour le DENV et le CHIKV par qRT-PCR, quatre cas sur 87 suspectés de ZIKV ont été confirmés positifs pour le DENV à la place (CT 26,6, 14,5, 29,5 et 34,4).
 Tableau 2. Nombre d’échantillons collectés et testés, et nombre de patients testés par qRT-PCR durant l’épidémie de ZIKV à Curaçao et Bonaire.
Tableau 2. Nombre d’échantillons collectés et testés, et nombre de patients testés par qRT-PCR durant l’épidémie de ZIKV à Curaçao et Bonaire.
Parmi les 324 patients ayant soumis des échantillons d’urine appariés entre décembre 2015 et octobre 2016, 70 patients ont été testés positifs pour leur premier échantillon, tandis que seuls 32 individus étaient encore positifs à la qRT-PCR pour leur second échantillon (Tableau 2), prélevé entre 11 et 17 jours après l’échantillon initial. Ceci indique que pour certains patients de cette cohorte, l’ARN du ZIKV était encore détectable dans l’urine jusqu’à 17 jours. De plus, une tendance significative à la diminution de la quantité de virus excrétée dans l’urine a été observée au cours de cette période (P < 0,0001, test t apparié) (Figure 1). Aucune différence significative n’a été constatée dans la quantité de virus excrétée dans l’urine entre les hommes et les femmes (données non présentées).
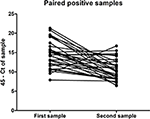 Figure 1. Quantité d’ARN du ZIKV détectée dans le premier et le second échantillon d’urine positif au ZIKV des échantillons appariés soumis pour analyse par 32 individus, exprimée en termes de seuil CT 45 moins le CT déterminé pour l’échantillon.
Figure 1. Quantité d’ARN du ZIKV détectée dans le premier et le second échantillon d’urine positif au ZIKV des échantillons appariés soumis pour analyse par 32 individus, exprimée en termes de seuil CT 45 moins le CT déterminé pour l’échantillon.
Durant la période du 17 octobre 2016 au 26 avril 2017, un total de 744 échantillons ont également été collectés auprès de 382 individus à Bonaire et analysés au MLS de Curaçao. Parmi ceux-ci, 599 échantillons appartenant à 358 patients ont été testés par qRT-PCR. Un total de 129 échantillons correspondant à 112 patients se sont révélés positifs au ZIKV par qRT-PCR. Parmi les 262 patients ayant fourni à la fois un échantillon de sérum et d’urine le même jour, 183 ont eu les deux échantillons testés simultanément par qRT-PCR. Parmi ceux-ci, 13 patients étaient positifs à la fois pour le sérum et l’urine, tandis que 17 patients étaient positifs uniquement pour le sérum, et 18 uniquement pour l’urine. Cent trente-cinq patients étaient négatifs pour les deux (Tableau 2).
Pour les deux îles, le pic du nombre absolu de cas est survenu en novembre 2016, avec 247 cas confirmés par qRT-PCR à Curaçao (Figure 2A) et 66 cas positifs par qRT-PCR à Bonaire (Figure 2C ; Tableau 3). En termes de prévalence, pour Curaçao, le pic (79%) s’est également produit en novembre 2016 (Figure 2B), tandis que pour Bonaire, le pic de prévalence (50%) a été atteint en octobre 2016 (Figure 2D ; Tableau 3). Globalement, une proportion plus élevée de femmes que d’hommes a été diagnostiquée (~73%) à la fois à Curaçao et à Bonaire (Tableau 4), avec des taux d’incidence respectifs de 737 et 875 pour 100 000. De plus, le ZIKV a été principalement diagnostiqué chez les individus de la catégorie d’âge 25-54 ans, tant à Curaçao (61% ; taux d’incidence de 863 pour 100 000) qu’à Bonaire (67% ; taux d’incidence de 815 pour 100 000) (Tableau 4).
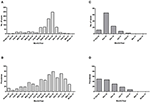 Figure 2. Nombre absolu de cas et prévalence des patients positifs au ZIKV confirmés par qRT-PCR à Curaçao de mi-décembre 2015 à fin avril 2017 (A,B), et à Bonaire de mi-octobre 2016 à fin avril 2017 (C,D).
Figure 2. Nombre absolu de cas et prévalence des patients positifs au ZIKV confirmés par qRT-PCR à Curaçao de mi-décembre 2015 à fin avril 2017 (A,B), et à Bonaire de mi-octobre 2016 à fin avril 2017 (C,D).
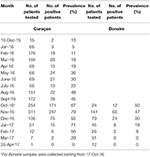 Tableau 3. Prévalence mensuelle des patients positifs au ZIKV confirmés par qRT-PCR à Curaçao et Bonaire durant l’épidémie.
Tableau 3. Prévalence mensuelle des patients positifs au ZIKV confirmés par qRT-PCR à Curaçao et Bonaire durant l’épidémie.
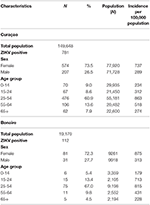 Tableau 4. Caractéristiques des 781 patients confirmés par qRT-PCR pour l’infection au ZIKV à Curaçao entre le 16 décembre 2015 et le 26 avril 2017, et des 112 patients confirmés à Bonaire entre le 17 octobre 2016 et le 26 avril 2017, selon le sexe et l’âge [en utilisant les données démographiques de la population de juillet 2017 (www.indexmundi.com)].
Tableau 4. Caractéristiques des 781 patients confirmés par qRT-PCR pour l’infection au ZIKV à Curaçao entre le 16 décembre 2015 et le 26 avril 2017, et des 112 patients confirmés à Bonaire entre le 17 octobre 2016 et le 26 avril 2017, selon le sexe et l’âge [en utilisant les données démographiques de la population de juillet 2017 (www.indexmundi.com)].
Afin de déterminer la distribution des infections au ZIKV à Curaçao, les emplacements des patients ayant obtenu un résultat positif pour le ZIKV par qRT-PCR ont été reportés sur une carte de Curaçao. Les emplacements de 197 patients n’ont pu être localisés avec précision sur la carte. La carte montre que la majorité des cas de ZIKV étaient regroupés dans la partie orientale de l’île, en particulier à Willemstad (Figure 3). Les zones géographiques présentant un nombre notable d’infections comprenaient Santa Rosa, Spaanse Water, St. Michiel, Dominguito, Brievengat, Berg Altena, Tera Cora, Stenen Koraal et Groot Piscadera.
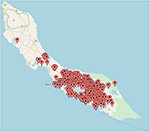 Figure 3. Les emplacements d’une sélection de patients à Curaçao ayant obtenu un résultat positif pour le ZIKV par qRT-PCR. La carte a été créée en reportant les emplacements sur www.mapcustomizer.com.
Figure 3. Les emplacements d’une sélection de patients à Curaçao ayant obtenu un résultat positif pour le ZIKV par qRT-PCR. La carte a été créée en reportant les emplacements sur www.mapcustomizer.com.
Discussion
Malgré l’émergence documentée du ZIKV dans les Amériques au Brésil en mai 2015, les analyses phylogénétiques estiment que l’introduction du virus est antérieure, soit entre août 2013 et juillet 2014 (38), soit entre mai et décembre 2013 (39). À Curaçao, selon nos analyses, les premiers cas de ZIKV ont été diagnostiqués en décembre 2015, un mois avant la première notification à l’OMS le 28 janvier 2016 (24), ce qui indique que le virus, très probablement introduit par des voyageurs, est apparu plus tôt que ce qui a été officiellement rapporté. Compte tenu de la propagation rapide du virus dans les Amériques après son émergence au Brésil, Curaçao et Bonaire n’étaient pas préparés à une épidémie de ZIKV, et les tests diagnostiques n’avaient donc pas encore été mis en œuvre et validés au MLS. Ce problème a été contourné en envoyant des échantillons de patients au laboratoire de diagnostic de l’EMC aux Pays-Bas, un Centre collaborateur de l’OMS pour les arbovirus. À partir d’octobre 2016, MLS Curaçao avait mis en place les tests de qRT-PCR et ELISA commerciaux nécessaires afin de poursuivre le diagnostic des patients suspectés de ZIKV à Curaçao et de commencer les diagnostics pour Bonaire. Il convient de noter que cette étude n’a pas été conçue de manière prospective mais réalisée en réaction à une situation d’épidémie dynamique.
Au cours de cette période, un changement a également été effectué, passant de l’urine au sérum pour les échantillons prélevés à Curaçao. Bien que quelques études aient montré que l’urine était plus sensible pour la détection du ZIKV par qRT-PCR par rapport au sérum (30, 31), les données des échantillons appariés de sérum et d’urine de Bonaire suggèrent que dans cette cohorte, ces deux matrices étaient nécessaires simultanément pour augmenter les chances de détection du ZIKV. Par conséquent, il est possible que de nombreux cas de ZIKV à Curaçao et à Bonaire n’aient pas été détectés car ici, des échantillons appariés d’urine et de sérum n’ont pas été systématiquement prélevés et/ou testés par qRT-PCR. Bien que de nombreux échantillons PCR-négatifs de Curaçao et de Bonaire aient également été testés par ELISA IgM/IgG, la réactivité croisée connue entre les anticorps du ZIKV et du DENV rend le diagnostic basé sur la sérologie difficile (36, 37) et pourrait facilement conduire à des faux positifs. Par conséquent, les données sérologiques des échantillons de patients prélevés 14 jours après l’apparition des symptômes n’ont pas été incluses dans nos analyses, et nos résultats sont donc très probablement une sous-représentation du nombre de cas de ZIKV sur les deux îles. Un autre facteur qui a pu conduire à une sous-représentation du nombre total de cas est le fait que tous les individus ayant présenté des symptômes ne se sont pas rendus chez le médecin généraliste pour se faire tester. De plus, à Curaçao, trois laboratoires ont participé au diagnostic des patients atteints de ZIKV, à savoir MLS, Analytisch Diagnostisch Centrum (ADC) et Laboratorio de Medicos (LabdeMed). Si toutes les données étaient combinées, le nombre total de cas de ZIKV serait probablement beaucoup plus important que celui présenté dans cet article.
Le pic de l’épidémie de ZIKV à Curaçao semble s’être produit en novembre 2016, tant en termes de nombre absolu de cas que de prévalence. Pour Bonaire, le pic du nombre absolu de cas semble également s’être produit en novembre 2016, tandis qu’en termes de prévalence, il semble s’être produit en octobre 2016. Cependant, comme aucun diagnostic de ZIKV n’a été effectué pour Bonaire entre mi-décembre 2015 et mi-octobre 2016, les données d’octobre ne sont pas fiables pour une comparaison avec les autres mois, et il ne peut être exclu qu’un plus grand nombre de personnes à Bonaire aient pu être infectées au cours de l’un des mois précédant novembre.
Il est intéressant de noter que, durant l’épidémie déclarée de ZIKV à Curaçao et Bonaire, aucun cas de microcéphalie ou de décès dû au ZIKV n’a été signalé. Cependant, en supposant un risque de microcéphalie similaire de 0,02% pour les femmes enceintes, tel que calculé pour le Brésil (40), et un taux de fécondité d’environ 2,1 pour Curaçao [basé sur les données de 2011 (41)], ce qui équivaut à environ 2 100 naissances vivantes par an, cela aurait donné 0,42 cas de microcéphalie durant l’épidémie à Curaçao (qui a duré approximativement une année). Il n’est donc pas surprenant qu’aucun cas de microcéphalie lié au ZIKV n’ait été observé dans une population de seulement 150 000 et 19 000 personnes.
Durant l’épidémie de ZIKV à Curaçao et à Bonaire, presque trois fois plus de femmes que d’hommes ont été infectées par le virus. Les infections sont survenues principalement dans la catégorie d’âge de 25 à 54 ans, tant pour les hommes que pour les femmes. Cette proportion plus élevée d’infections féminines durant une épidémie de ZIKV a également été rapportée au Surinam (42) et à Rio de Janeiro au Brésil (43). Ce taux d’infection disproportionné peut s’expliquer par le dépistage accru des femmes enceintes en raison des préoccupations concernant la microcéphalie et d’autres risques pour les fœtus. Cependant, une telle tendance a également été démontrée à Rio de Janeiro durant une épidémie de DENV (43), où les femmes avaient 30% plus de probabilités d’être diagnostiquées avec le DENV que les hommes. Une explication suggérée par cette étude était que les femmes sont plus consciencieuses concernant leur santé et donc plus susceptibles de consulter un médecin généraliste. Néanmoins, une autre possibilité, comme également spéculé dans l’étude de Coelho (43), est que pour le ZIKV, un nombre plus élevé de transmissions sexuelles d’homme à femme se produisent en comparaison aux transmissions de femme à homme. L’infection des femmes par le ZIKV via le sperme a déjà été démontrée (1–3), et même si le ZIKV a également été détecté dans l’appareil génital féminin et les sécrétions vaginales (44–47), la capacité du virus à infecter productivement les hommes via les sécrétions vaginales lors de rapports sexuels n’a pas encore été démontrée. De plus, l’influence des hormones reproductives féminines sur la réplication et la transmission du ZIKV devrait également être étudiée, car il a récemment été démontré que les progestatifs favorisent l’infection par le VIH dans le tractus reproductif féminin des primates non humains (48).
Afin d’obtenir une impression de la distribution du nombre de cas de ZIKV à Curaçao, les localisations des patients ont été reportées sur une carte. La majorité des cas étaient situés à l’est de l’île, ce qui peut résulter d’un biais de déclaration causé par une densité de population plus élevée à l’est (Willemstad) (41). Néanmoins, pour les zones géographiques contenant le plus grand nombre de cas de ZIKV, aucune tendance particulière en termes de densité de population ou de revenu mensuel brut moyen par ménage n’a été identifiée (données non présentées). Il est possible que la distribution géospatiale des cas de ZIKV reflète la présence de moustiques infectés par le ZIKV ; cependant, comme de nombreux habitants de Curaçao se déplacent quotidiennement vers différentes parties de l’île, il n’est pas possible de déterminer avec certitude le lieu de transmission. Outre la transmission par les moustiques, la transmission sexuelle du ZIKV peut également avoir influencé la distribution géospatiale des cas sur l’île.
Conclusions
Comme Curaçao et Bonaire sont des points chauds (potentiels) pour les infections arbovirales émergentes et ré-émergentes, il est important que les îles soient préparées aux futures épidémies en mettant en place à l’avance les outils diagnostiques appropriés. Cependant, en plus de diagnostics efficaces, il est impératif que l’infrastructure adéquate soit également mise en place pour permettre la communication durant une situation d’épidémie et faciliter la mise en œuvre d’activités de réduction des risques afin de faire face à toute maladie infectieuse qui pourrait émerger à l’avenir.
Déclaration de Disponibilité des Données
Les ensembles de données générés et/ou analysés au cours de la présente étude ne sont pas publiquement disponibles en raison des droits à la vie privée des patients, mais une sélection d’ensembles de données est disponible auprès de l’auteur correspondant sur demande raisonnable.
Déclaration Éthique
Un consentement écrit a été obtenu de chaque individu ayant fourni des échantillons d’urine, de sérum ou de plasma. Le consentement pour les enfants de moins de 16 ans a été fourni par leur parent ou tuteur. Comme MLS et le département de Virologie sont mandatés pour fournir un soutien de laboratoire pour les enquêtes sur les épidémies, aucune autorisation éthique supplémentaire n’a été recherchée.
Contributions des Auteurs
RW, SP, et GB ont coordonné et supervisé les diagnostics de laboratoire et la logistique. SL, SP, et GB ont été impliqués dans les analyses. SL, SP, MK, et BM ont rédigé le manuscrit.
Financement
Les recherches ayant abouti à ces résultats ont reçu un financement de COMPARE (Programme Horizon 2020 de l’Union européenne, convention de subvention n° 643476), ZikaRisk (Projet NWO ZonMW n° 522003001) et ZIKAlliance (Programme Horizon 2020 de l’Union européenne, convention de subvention n° 734548). Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publier ou la préparation du manuscrit.
Conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous tenons à remercier tout le personnel de laboratoire et les membres du personnel de MLS et du département de Virologie pour leurs contributions techniques et organisationnelles.
Abréviations
ZIKV, virus Zika ; DENV, virus de la dengue ; CHIKV, virus chikungunya ; IgM, immunoglobuline M ; IgG, immunoglobuline G ; ELISA, dosage d’immunoabsorption par enzyme liée ; qRT-PCR, réaction en chaîne par polymérase quantitative en temps réel ; ARN, acide ribonucléique ; EDTA, acide éthylènediaminetétraacétique ; OMS, Organisation mondiale de la Santé ; NAT, test d’amplification des acides nucléiques ; MLS, Services de Laboratoire Médical ; EMC, Centre Médical Erasmus ; NS2A, protéine non structurale 2A ; PDV, virus de la maladie de Carré du phoque ; CT, seuil de cycle ; FTD, Fast Track Diagnostics ; ADC, Analytisch Diagnostisch Centrum ; VIH, virus de l’immunodéficience humaine.
Références
1. Foy BD, Kobylinski KC, Chilson Foy JL, Blitvich BJ, Travassos da Rosa A, Haddow AD, et al. Transmission probable du virus Zika sans vecteur, Colorado, États-Unis. Emerg Infect Dis. (2011) 17:880–2. doi: 10.3201/eid1705.101939
2. Hills SL, Russell K, Hennessey M, Williams C, Oster AM, Fischer M, et al. Transmission du virus Zika par contact sexuel avec des voyageurs dans les zones de transmission continue – États-Unis continentaux, 2016. MMWR Morb Mortal Wkly Rep. (2016) 65:215–6. doi: 10.15585/mmwr.mm6508e2
3. D’Ortenzio E, Matheron S, Yazdanpanah Y, de Lamballerie X, Hubert B, Piorkowski G, et al. Preuve de transmission sexuelle du virus Zika. N Engl J Med. (2016) 374:2195–8. doi: 10.1056/NEJMc1604449
4. Calvet G, Aguiar RS, Melo ASO, Sampaio SA, de Filippis I, Fabri A, et al. Détection et séquençage du virus Zika dans le liquide amniotique de fœtus atteints de microcéphalie au Brésil : une étude de cas. Lancet Infect Dis. (2016) 16:653–60. doi: 10.1016/S1473-3099(16)00095-5
5. Galán-Huerta KA, Rivas-Estillaa AM, Martinez-Landerosb EA, Arellanos-Sotoab D, Ramos-Jiménez J. La maladie du virus Zika : un aperçu. Med Univ. (2016) 18:115–24. doi: 10.1016/j.rmu.2016.05.003
7. Cao-Lormeau VM, Blake A, Mons S, Lastère S, Roche C, Vanhomwegen J, et al. Épidémie de syndrome de Guillain-Barré associée à l’infection par le virus Zika en Polynésie française : une étude cas-témoins. Lancet. (2016) 387:1531–9. doi: 10.1016/S0140-6736(16)00562-6
8. Roze B, Najioullah F, Fergé JL, Dorléans F, Apetse K, Barnay JL, et al. Syndrome de Guillain-Barré associé à l’infection par le virus Zika en Martinique en 2016 : une étude prospective. Clin Infect Dis. (2017) 65:1462–8. doi: 10.1093/cid/cix588
10. Araujo LM, Ferreira ML, Nascimento OJ. Syndrome de Guillain-Barré associé à l’épidémie du virus Zika au Brésil. Arq Neuropsiquiatr. (2016) 74:253–5. doi: 10.1590/0004-282X20160035
11. Yepez JB, Murati FA, Pettito M, Peñaranda CF, de Yepez J, Maestre G, et al. Manifestations ophtalmologiques du syndrome congénital du Zika en Colombie et au Venezuela. JAMA Ophthalmol. (2017) 135:440–5. doi: 10.1001/jamaophthalmol.2017.0561
12. Kodati S, Palmore TN, Spellman FA, Cunningham D, Weistrop B, Sen HN. Uvéite postérieure bilatérale associée à l’infection par le virus Zika. Lancet. (2017) 389:125–6. doi: 10.1016/S0140-6736(16)32518-1
13. Wong CW, Ng SR, Cheung CMG, Wong TY, Mathur R. Maculopathie liée au Zika. Retin Cases Brief Rep. (2019) 13:171–3. doi: 10.1097/ICB.0000000000000552
14. Miranda-Filho DDB, Martelli CM, Ximenes RA, Araújo TV, Rocha MA, Ramos RC, et al. Description initiale du syndrome congénital présumé du Zika. Am J Public Health. (2016) 106:598–600. doi: 10.2105/AJPH.2016.303115
15. de Araujo TVB, Rodrigues LC, de Alencar Ximenes RA, de Barros Miranda-Filho D, Montarroyos UR, de Melo APL, et al. Association entre l’infection par le virus Zika et la microcéphalie au Brésil, de janvier à mai 2016 : rapport préliminaire d’une étude cas-témoins. Lancet Infect Dis. (2016) 16:1356–63. doi: 10.1016/S1473-3099(16)30318-8
16. Rubin EJ, Greene MF, Baden LR. Virus Zika et microcéphalie. N Engl J Med. (2016) 374:984–5. doi: 10.1056/NEJMe1601862
17. Honein MA, Dawson AL, Petersen EE, Jones AM, Lee EH, Yazdy MM, et al. Malformations congénitales chez les fœtus et les nourrissons de femmes américaines présentant des preuves d’une possible infection par le virus Zika pendant la grossesse. JAMA. (2017) 317:59–68. doi: 10.1001/jama.2016.19006
18. Brasil P, Pereira JP Jr, Moreira ME, Ribeiro Nogueira RM, Damasceno L, Wakimoto M, et al. Infection par le virus Zika chez les femmes enceintes à Rio de Janeiro. N Engl J Med. (2016) 375:2321–34. doi: 10.1056/NEJMoa1602412
19. Duffy MR, Chen TH, Hancock WT, Powers AM, Kool JL, Lanciotti RS, et al. Épidémie de virus Zika sur l’île de Yap, États fédérés de Micronésie. N Engl J Med. (2009) 360:2536–43. doi: 10.1056/NEJMoa0805715
20. Roth A, Mercier A, Lepers C, Hoy D, Duituturaga S, Benyon E, et al. Épidémies simultanées d’infections par les virus de la dengue, du chikungunya et du Zika – une vague épidémique sans précédent de virus transmis par les moustiques dans le Pacifique 2012-2014. Euro Surveill. (2014) 19:20929. doi: 10.2807/1560-7917.ES2014.19.41.20929
21. Tognarelli J, Ulloa S, Villagra E, Lagos J, Aguayo C, Fasce R, et al. Un rapport sur l’épidémie de virus Zika sur l’île de Pâques, Pacifique Sud, 2014. Arch Virol. (2016) 161:665–8. doi: 10.1007/s00705-015-2695-5
22. Dupont-Rouzeyrol M, O’Connor O, Calvez E, Daurès M, John M, Grangeon JP, et al. Co-infection par les virus Zika et de la dengue chez 2 patients, Nouvelle-Calédonie, 2014. Emerg Infect Dis. (2015) 21:381–2. doi: 10.3201/eid2102.141553
23. Fauci AS, Morens DM. Le virus Zika dans les Amériques – une nouvelle menace arbovirale. N Engl J Med. (2016) 374:601–4. doi: 10.1056/NEJMp1600297
24. Kindhauser MK, Allen T, Frank V, Santhana RS, Dye C. Zika : l’origine et la propagation d’un virus transmis par les moustiques. Bull World Health Organ. (2016) 94:675–86C. doi: 10.2471/BLT.16.171082
25. Organisation panaméricaine de la Santé/Organisation mondiale de la Santé. Chronologie de l’émergence du virus Zika dans les Amériques. Washington, DC : Organisation panaméricaine de la Santé/Organisation mondiale de la Santé (2016).
26. Ministério da Saúde. Protocole de surveillance et de réponse à l’occurrence de microcéphalie liée à l’infection par le virus Zika. Brasília : Département de surveillance des maladies transmissibles, Centre de communication/SVS (2015).
27. Organisation panaméricaine de la Santé/Organisation mondiale de la Santé. PLISA : Plateforme d’information sanitaire pour les Amériques – Cas de dengue signalés dans les Amériques. Organisation panaméricaine de la Santé/Organisation mondiale de la Santé. Disponible sur : http://www.paho.org/data/index.php/en/mnu-topics/indicadores-dengue-en/dengue-nacional-en/252-dengue-pais-ano-en.html (consulté le 19 juillet 2018).
28. Organisation panaméricaine de la Santé/Organisation mondiale de la Santé. Nombre de cas signalés de fièvre chikungunya dans les Amériques, par pays ou territoire 2013-2014, cas cumulés, SE 49. (2014). Disponible sur : https://www.paho.org/hq/dmdocuments/2014/2014-dec-05-cha-chikungunya-cases-ew-49.pdf (consulté le 14 novembre 2018).
29. Lanciotti RS, Kosoy OL, Laven JJ, Velez JO, Lambert AJ, Johnson AJ, et al. Propriétés génétiques et sérologiques du virus Zika associé à une épidémie, État de Yap, Micronésie, 2007. Emerg Infect Dis. (2008) 14:1232–9. doi: 10.3201/eid1408.080287
30. Gourinat AC, O’Connor O, Calvez E, Goarant C, Dupont-Rouzeyrol M. Détection du virus Zika dans l’urine. Emerg Infect Dis. (2015) 21:84–6. doi: 10.3201/eid2101.140894
31. Lamb LE, Bartolone SN, Kutluay SB, Robledo D, Porras A, Plata M, et al. Avantage du diagnostic moléculaire urinaire du virus Zika. Int Urol Nephrol. (2016) 48:1961–6. doi: 10.1007/s11255-016-1406-9
32. Lustig Y, Mendelson E, Paran N, Melamed S, Schwartz E. Détection de l’ARN du virus Zika dans le sang total de cas importés de maladie à virus Zika jusqu’à 2 mois après l’apparition des symptômes, Israël, décembre 2015 à avril 2016. Euro Surveill. (2016) 21:30269. doi: 10.2807/1560-7917.ES.2016.21.26.30269
33. Organisation mondiale de la Santé. Tests de laboratoire pour l’infection par le virus Zika, WHO/ZIKV/LAB/16.1 (2016).
34. Ferreira-de-Brito A, Ribeiro IP, Miranda RM, Fernandes RS, Campos SS, Silva KA, et al. Première détection d’une infection naturelle d’Aedes aegypti par le virus Zika au Brésil et dans toute l’Amérique du Sud. Mem Inst Oswaldo Cruz. (2016) 111:655–8. doi: 10.1590/0074-02760160332
35. Hoek RA, Paats MS, Pas SD, Bakker M, Hoogsteden HC, Boucher CA, et al. Incidence des agents pathogènes respiratoires viraux provoquant des exacerbations chez les patients adultes atteints de mucoviscidose. Scand J Infect Dis. (2013) 45:65–9. doi: 10.3109/00365548.2012.708942
36. Priyamvada L, Quicke KM, Hudson WH, Onlamoon N, Sewatanon J, Edupuganti S, et al. Les réponses anticorps humaines après l’infection par le virus de la dengue sont hautement réactives de manière croisée au virus Zika. Proc Natl Acad Sci USA. (2016) 113:7852–7. doi: 10.1073/pnas.1607931113
37. Felix AC, Souza NCS, Figueiredo WM, Costa AA, Inenami M, da Silva RMG, et al. Réactivité croisée des immunodosages anti-dengue commerciaux chez les patients atteints d’une infection aiguë par le virus Zika. J Med Virol. (2017) 89:1477–9. doi: 10.1002/jmv.24789
38. Metsky HC, Matranga CB, Wohl S, Schaffner SF, Freije CA, Winnicki SM, et al. Évolution et propagation du virus Zika dans les Amériques. Nature. (2017) 546:411–5. doi: 10.1038/nature22402
39. Faria NR, Azevedo RDSDS, Kraemer MUG, Souza R, Cunha MS, Hill SC, et al. Le virus Zika dans les Amériques : premières découvertes épidémiologiques et génétiques. Science. (2016) 352:345–9. doi: 10.1126/science.aaf5036
40. Jaenisch T, Rosenberger KD, Brito C, Brady O, Brasil P, Marques ETA. Risque de microcéphalie après l’infection par le virus Zika au Brésil, de 2015 à 2016. Bull World Health Organ. (2017) 95:191–8. doi: 10.2471/BLT.16.178608
42. Codrington J, Roosblad J, Baidjoe A, Holband N, Adde A, Kazanji M, et al. Épidémie de virus Zika au Suriname, un rapport basé sur les données de surveillance en laboratoire. PLoS Curr. (2018) 10. doi: 10.1371/currents.outbreaks.ff0f6190d5431c2a2e824255eaeaf339
43. Coelho FC, Durovni B, Saraceni V, Lemos C, Codeco CT, Camargo S, et al. L’incidence plus élevée de Zika chez les femmes adultes que chez les hommes adultes à Rio de Janeiro suggère une contribution significative de la transmission sexuelle des hommes aux femmes. Int J Infect Dis. (2016) 51:128–32. doi: 10.1016/j.ijid.2016.08.023
44. Penot P, Brichler S, Guilleminot J, Lascoux-Combe C, Taulera O, Gordien E, et al. Virus Zika infectieux dans les sécrétions vaginales d’une femme séropositive, France, août 2016. Euro Surveill. (2017) 22:30444. doi: 10.2807/1560-7917.ES.2017.22.3.30444
46. Tang WW, Young MP, Mamidi A, Regla-Nava JA, Kim K, Shresta S. Un modèle murin de transmission sexuelle du virus Zika et de réplication virale vaginale. Cell Rep. (2016) 17:3091–8. doi: 10.1016/j.celrep.2016.11.070
47. Sanchez-Montalva A, Pou D, Sulleiro E, Salvador F, Bocanegra C, Treviño B, et al. Dynamique du virus Zika dans les fluides corporels et risque de transmission sexuelle dans une zone non endémique. Trop Med Int Health. (2018) 23:92–100. doi: 10.1111/tmi.13019
48. Carias AM, Allen SA, Fought AJ, Kotnik Halavaty K, Anderson MR, Jimenez ML, et al. L’augmentation des progestatifs endogènes ou exogènes favorise les interactions virus-cellules cibles dans le tractus reproducteur femelle des primates non humains. PLoS Pathog. (2016) 12:e1005885. doi: 10.1371/journal.ppat.1005885
Mots-clés : Virus Zika, épidémie, laboratoire, qRT-PCR, épidémiologie, Curaçao, Bonaire
Citation : Lim SM, Wever R, Pas SD, Bonofacio G, Koopmans MPG et Martina BEE (2019) Épidémie de virus Zika à Curaçao et Bonaire, un rapport basé sur les données de diagnostic en laboratoire. Front. Public Health 7:333. doi: 10.3389/fpubh.2019.00333
Reçu : 11 juin 2019 ; Accepté : 25 octobre 2019 ;
Édité par :
Évalué par :
Man-Qing Liu, Centre de prévention et de contrôle des maladies de Wuhan, Chine
José Eduardo Levi, Université de São Paulo, Brésil
Copyright © 2019 Lim, Wever, Pas, Bonofacio, Koopmans et Martina. Ceci est un article en libre accès distribué selon les termes de la Licence Creative Commons Attribution (CC BY). L’utilisation, la distribution ou la reproduction dans d’autres forums est autorisée, à condition que l’auteur ou les auteurs originaux et le(s) titulaire(s) du droit d’auteur soient crédités et que la publication originale dans cette revue soit citée, conformément aux pratiques académiques acceptées. Aucune utilisation, distribution ou reproduction n’est autorisée si elle ne respecte pas ces conditions.
*Correspondance : Stephanie M. Lim, [email protected]